GCP省令とは?ICH-GCP、GCPガイダンスなど混同しがちな用語も含めて解説

本コラムでは、医薬品・医療機器開発に携わる方なら最低限押さえておきたい「GCP省令」をはじめ、その他、混同しがちな医薬品・医療機器開発に関わる法令・用語を簡単にご紹介します。
初めて医薬品・医療機器開発に関わる方だけでなく、医薬品・医療機器開発に携わってから時間が空いてしまった方も、ぜひ、おさらいとして目を通してみてください。
目次
1.GCPとは
「GCP」とは、”Good Clinical Practice“の頭文字を取ったもので、日本語では「医薬品の臨床試験の実施の基準」と訳されます。
GCPに規定されている内容は、主に下記があります。
- 医薬品の臨床試験に関する基準
- 被験者の人権保護、安全性確保
- 治験の質の確保
- データの信頼性の確保
- 責任・役割分担の明確化
- 記録の保存
GCPは、日米EU医薬品規制調和会議(ICH)で合意された考え方で、欧米をはじめ国際的に、医薬品・医療機器の開発で遵守することが求められる規準が示されています。
[※GCP初心者向けの関連記事:GCPの概要・早わかり解説もご参照ください]
2.医薬品・医療機器開発の規準を定めたGCP省令
医薬品・医療機器開発における臨床試験は、被験者の権利や安全が脅かされることがないよう、十分に注意しなくてはなりません。また、試験結果の信頼性の確保も重要です。
日本では、医薬品・医療機器開発で遵守する規定が、薬機法(医薬品医療機器法)に基づき、GCP省令で定められています。
(1)GCP省令とは
GCP省令の正式名称は、「医薬品の臨床試験の実施の基準に関する省令」です。
主に、臨床試験について規定されています。
1996年、日米EU医薬品規制調和会議(ICH)で、医薬品の臨床試験の実施の基準(GCP)について、3地域統一のガイドライン(ICH-GCPガイドライン)が合意されたことを受け、翌年、国内医療制度を反映し、GCP省令が定められました。
臨床試験の実施規定の他、臨床試験結果の報告義務や、治験施設支援機関・治験審査委員会の役割が記載されています。
1998年以降、医薬品・医療機器開発の臨床試験は、GCP省令を遵守して行なうことが、法律で義務付けられました。
(2)GCP省令の目的
GCP省令は被験者の権利と安全に最大限配慮し、かつ、試験結果の信頼性を確保することを目的に定められました。
また、国際的な基準であるICH-GCPをもとに規定されており、日米欧間で簡便かつ迅速に新薬承認を行えるよう、国際的な整合性にも配慮されています。
3.GCP省令と混同しがちな用語
医薬品・医療機器開発に関わる法律用語はGCP省令以外にも数多くあります。
ここからは、Googleの検索ワードから、GCP省令に馴染みのない方が混同しがちな用語をピックアップしてご紹介します。
(1)ICH-GCP
「ICH-GCP」は、GCP省令のもとになった国際的な基準です。
医薬品の臨床試験結果を日米EU間で相互共有するため、日米EU医薬品規制調和会議(ICH)で、医薬品の臨床試験の実施の基準(GCP)について合意されました。
GCP省令は、3地域間統一のガイドラインとして制定された、ICH-GCPガイドライン(TheInternationalConferenceonHarmonizationguidelinesdefineGoodClinicalPractice)に基づいて規定されています。
ICH-GCPとGCP省令の相違項目は以下の通りです。
- 実施体制
- 倫理審査委員会・治験審査委員会
- 被験者との契約者や契約項目
- 治験薬の管理
- 同意取得
- 安全情報の報告等
- 記録の保存
各地域の医療体制の差異により、上記項目でGCP省令と規定が異なります。
GCP関連の基礎知識だけを確認したい方は、ICH-GCPは、GCP省令のもとになった国際的な基準と覚えておけばよいでしょう。
(2)GCPガイダンス
「GCPガイダンス」とは、治験等を行うにあたり、GCP省令に適合した円滑な実施の参考となるよう、薬生薬審発で示されているものです。
以前は「GCP運用通知」として示されていましたが、平成24年12月28日に「GCPガイダンス」と改名されました。適時改正されており、直近では令和3年7月30日に改正されています。
GCPガイダンスは、「被験者の人権保護」「安全保持」「治験の科学的な質および成績の信頼性」の観点から、GCP省令に適合した治験等を実施するための一例を示したものです。
GCP省令に適合していれば、GCPガイダンスに示された運用方法以外でも治験等を実施できます。
(3)薬機法(医薬品医療機器法)
「薬機法」(医薬品医療機器法)とは、医薬品・医療機器開発に関わる法律で、正式名称を「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」といいます。
平成26年まで「薬事法」と呼ばれていました。
薬機法(医薬品医療機器法)とGCP省令は共に、医薬品・医療機器開発に関わる法令です。
医薬品・医療機器開発に馴染みの薄い方は混同しがちなため、注意しましょう。
薬機法(医薬品医療機器法)は「法律」です。
一方、GCP省令は治験の実施について定められた「省令」で、薬機法(医薬品医療機器法)内で規定されています。
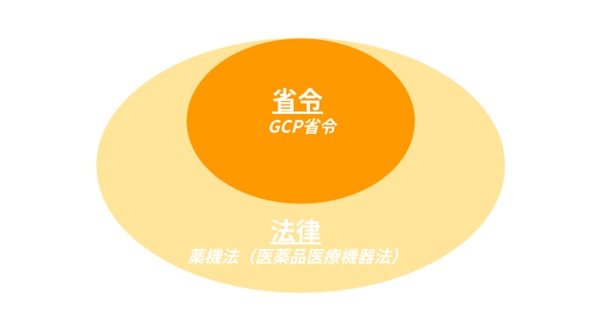
【図1 法律と省令の概念図】
4.医薬品・医療機器開発に携わる前に基本知識を押さえよう
今回は、医薬品・医療機器開発に携わる方が最低限押さえておきたい基本知識として、GCP省令や、GCP省令と混同しやすい用語をご紹介しました。
医薬品・医療機器開発で遵守が求められる規則は細かく規定されています。
また、頻繁に改定が行われるため、常に最新情報を把握しておくことが重要です。
医薬品・医療機器開発に関わる法令等の知識に不安がある方は、詳しく学べるセミナーの受講を検討しても良いでしょう。
アイアール技術者教育研究所では、実績ある主催者が開催するGCP関連セミナーも多数ご紹介しています。ご興味のある方は、ぜひセミナー情報をご覧ください。
(アイアール技術者教育研究所 S・N)
《引用文献・参考文献》
- [1]ICH-GCPと省令GCPの主な相違点
- [2]我が国のGCPとICH-GCPの比較(まとめ)
- [3]薬生薬審発0730第3号令和3年7月30日各都道府県衛生主管部(局)長殿厚生労働省医薬・
- [4]医薬品の開発に関わる規制について-治験 発ケン!広島県