【分析化学を学ぶ】発光スペクトルとは?

今回のコラムでは、分光分析の知識のうち「発光スペクトル」について解説します。
1.発光スペクトルとは?
物質は光を吸収すると基底状態から励起状態に変換します。
安定な基底状態に戻ろうとするときに、吸収したエネルギーを振動等の熱的に変換した分子もありますが、光として放射する(発光)物質もあります。
放射する光の強度をその波長などに対して表示するものが「発光スペクトル」です。
発光スペクトルを解析すると、励起状態の分子構造が分かります。
また、物質が発光した光子数と吸収した光子数の比は「発光量子収率」といいますが、この数値が1に近いほど優れた発光体であり、正確な発光量子収率を決定することは非常に重要な光物性測定の1つです。
2.励起一重項と励起三重項状態
(1)内部転換と項間交差
ご存じのように、光は電磁波でもあり、振動する電場を持っています。
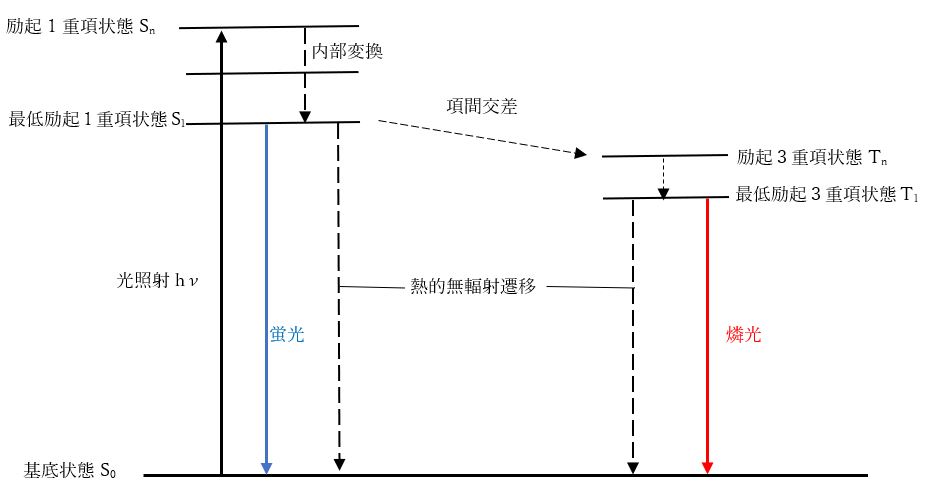
物質の中を通るときに構成する原子や分子の電子は、光の振動電場に揺さぶられて、基底状態からエネルギーの高い電子軌道に遷移します。この電子にはスピンの向きがあり、多くの有機物は閉殻構造で、基底状態ではすべての電子が対になって逆向きで存在する(パウリの排他原理)スピン一重項状態S0です。エネルギーを吸収して励起されると、同じスピン多重度の一重項状態のままで高いエネルギー準位の励起1重項状態Snとなります。そして分子内振動などの熱的な変換により、最低励起1重項状態S1までに緩和します。
これを「内部転換」と言います。逆に異なるスピン多重度状態に転換することを「項間交差」と呼びます。遷移金属錯体の場合、項間交差も高速で起こります。
一般的に、S1状態の一つの電子スピンが反転して生成した3重項状態T1は、よりエネルギーが低くて安定です。そのためS1状態の電子は励起されて、励起三重項状態Tnに項間交差し、内部転換によって最低3重項状態T1を生じます(図1、図2)。
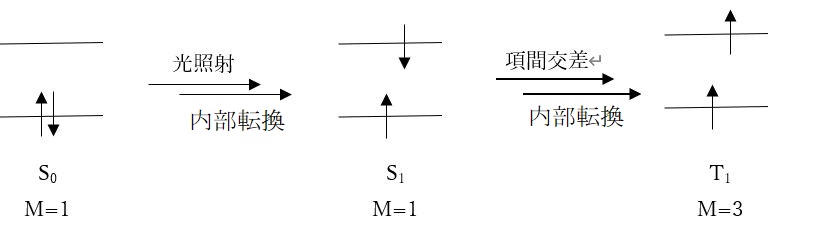
[図1.一重項と三重項状態の電子配置]
(2)「蛍光」と「燐光」
図2に示したようにS1-S0の同じスピン多重度状態間の輻射遷移で生じる光を「蛍光」と言います。T1-S0のように異なるスピン多重度を持つ励起状態からの発光は「燐光」といいます。
芳香性有機化合物の多くは発光性質を持っていますが、そのほとんどは励起一重項からの発光で「蛍光」と呼びます。有機分子の場合、電子スピンの変化を伴う遷移は禁制ですので、燐光はほとんど観測できません。
ここでアントラセンの発光現象を挙げて、励起1重項と3重項の性質の違いを説明します。
アントラセンのメタノール溶液に室温で紫外光を照射すると、青色の発光が観測され、光照射を止めるとすぐに消えます。
一方、アントラセンのEPA(エーテル/イソペンタン/エタノール)との混合溶液を液体窒素で凍らせて、紫外線を当ててみます。照射している間、室温の時と同様に青色の発光がみられますが、照射を切ると、赤色の発光はしばらく観測され続けます。
この青色の発光は、高エネルギーで寿命の短い1重項からの蛍光です。赤色の発光の原因は、より低エネルギーで寿命の長い励起3重項状態からの燐光です。通常、有機分子の場合は、スピン変化を伴う遷移は禁制であるため、ゆっくり起こって励起3重項状態となりますが、室温では他の失活過程が速いので、3重項からの燐光は観測されません。冷やすと、失活過程が抑制されるため、燐光は観測されます。また、遷移金属錯体の場合、重原子効果のため、スピンの反転を伴う遷移は禁制でなくなり、高速で起こります。発光現象や光化学反応はほとんど励起3重項状態から起こります。
[図2.蛍光と燐光の遷移過程]
3.発光スペクトルの表示方法
発光スペクトルは、単位面積の観測面に届く光の強度をその波長などに対して表示したものです。
表示方法は四種類があって、表示方法によって、スペクトル形状も異なるので、注意が必要です。
- 単位波長当たりの放射照度E(λ)(Wm-2nm-1)
- 単位波長当たりの光子数Eq(λ)(光子数m-2nm-1)
- 単位波数当たりの放射照度E(ν)(Wm-2cm-1)
- 単位波数当たりの光子数Eq(ν)(光子数m-2cm-1)
を波数(ν)に対して表示したスペクトルです。
これらのスペクトル強度は式1に示した関係で変換できます。
λ3E(λ)=λ2Eq(λ)=λE(ν)=Eq(ν) ・・・式1
発光量子収率を求めるときには、Eq(λ)と Eq(ν)で表示した発光スペクトルの面積積分により、放出光子数を求められます。吸収発光スペクトルの鏡像関係を確認するためには、波数表示のスペクトルを用いるべきでしょう。
燐光の寿命は蛍光より長いですが、酸素と溶媒の影響を受けやすく消光してしまうため、試料を繰り返し凍結脱気したり、不活性ガス置換の工夫が必要になります。測定する際には注意しておきましょう。
4.発光量子収率
物質が光を吸収した後、発光によってエネルギーを放出する時に、吸収された光子数に対する放出される光子数の割合を「発光量子収率」といいます(式2)。
発光量子収率=(放出された光子数)/(吸収した光子数) ・・・式2
発光量子収率は1に近いほど優れた発光体で、逆に、0に近い物質は遷移の時にまったく光子を放出しないということとなります。
発光量子収率を決めるには式3のように、標準物質との発光強度を比較する相対法がよく使われます。標準物質は、励起波長や発光波長領域及び溶媒が、できるだけ試料と近い物を選びます。
測定する際は、標準物質と試料の吸光と発光をそれぞれ測定します。濃度が高い試料は、発光の消光が起こる可能性がありますので、普通は励起波長における吸光度が0.05Abs以下に希釈して、測定します。
発光量子収率は式3によって求めます。
Φu=Φs(Ks/Ku)(Is/Iu)(nu2/ns2)(Au/As) ・・・式3
Φu、Φsは試料と標準物質の発光量子収率です。
Iは積分発光強度、Eq(λ)と Eq(ν)表示の発光スペクトルの全面積により求められます。
Aは吸光度、nは屈折率、Kは希釈した場合の希釈率です。
(日本アイアール株式会社 特許調査部 H・L)