不斉有機分子触媒とは?初心者向けにわかりやすく解説

2021年度ノーベル化学賞の受賞対象になった不斉有機分子触媒は、僅か21年前にList、MacMillan両博士が、それぞれ独立かつ独自に行った実験が出発点となりました。
既に多くの専門的な解説がありますが、ここではこの分野を専門としない読者を対象として、有機分子触媒の紹介と技術的価値をご説明します。
目次
1.不斉有機分子触媒の発見
(1)Benjamin Listの触媒
受賞対象となった研究はListがまだ教授になる前、米国のスクリプス研究所で博士研究員から助教授になったばかりの30歳頃の仕事です。彼は生体触媒(酵素)の研究を行っていました。触媒作用に必要なのは巨大な酵素全体ではなく、そのごく一部のアミノ酸構造に活性点があることが既に分かっていました。1)
そこで、アルドラーゼという酵素のアミノ酸成分であるL-プロリンを使ってアルドール反応を行い、発見に至ったとされています(式1)。2)
本人でさえ確固たる自信はなく、彼に与えられた本来の研究テーマでもなかったので、上司にも同僚にも内緒で行った実験であったという逸話があります。3)
科学研究の醍醐味であり、化学者のセレンディピティーです。
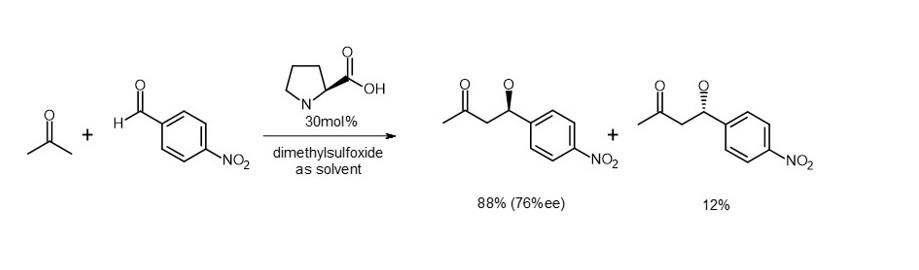
(式1)
(2)David MacMillanの触媒
MacMillanの受賞対象研究も彼が30歳頃の仕事です。
MacMillanは当時、錯体触媒の研究を行っており、触媒の取り扱いの煩雑さもあって、利便性に欠けることを懸念していたそうです。そこで金属を使わない触媒を考え、この成果に至りました。4)
ディールス・アルダー反応という二つの分子から環状化合物を作る反応があります。一方の分子をイミニウムイオンに変換しておくとディールス・アルダー反応が進行しやすいことから、彼はイミニウムイオンに変換し易い試剤を触媒として使えば、系内でイオンが生じて反応が進むようになると考えました。
この試剤には大きな置換基をある立体配置で導入しておき、その嵩高さを利用して生成物の立体的な構造を一方に偏らせることができ、「不斉を誘起する有機分子触媒」が完成しました(式2)。5)
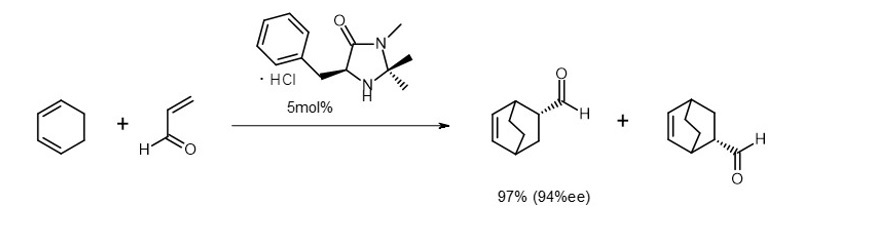
(式2)
Listは生体触媒の研究から、MacMillanは金属錯体触媒の研究から同じ着想を得たことになります。
「科学の多様性と単一性」を象徴的に示しています。
2.立体化学について
ここで立体化学について簡単に説明します。
炭素には単結合を介して4つの原子や官能基が結合できます。
分子式が同じでも違う化合物ということがあります。
図1のAでは炭素原子a1にメチレン基a2、メチル基a3、酸素原子a4、窒素原子a5が結合しています。a3-a1-a2結合面を紙上に置いた場合、a4、a5とBのb4、b5は紙面の裏表逆にa1、b1に結合しています。
次にBを上から下へ180°、右へ180°回転すると分子Aを鏡に映した像はと同一になります(単結合b1-b2は自由回転可能)。これは「鏡像体(enantiomer)」と呼ばれます。
ある反応を行ってaとbの混合物が生成した場合、立体化学を考慮しない反応の生成物は50:50の混合物(ラセミ体)ですが、不斉合成を行ってa:b=99:1の組成の生成物を得たとします。
立体特異的な反応で生成した分子の立体的な選択性を「鏡像体過剰率(enantiomeric excess; ee)」で表わします。計算式は (a-b)/(a+b)% となり、上の例では98%eeです(式1,2の生成比率を参照)。
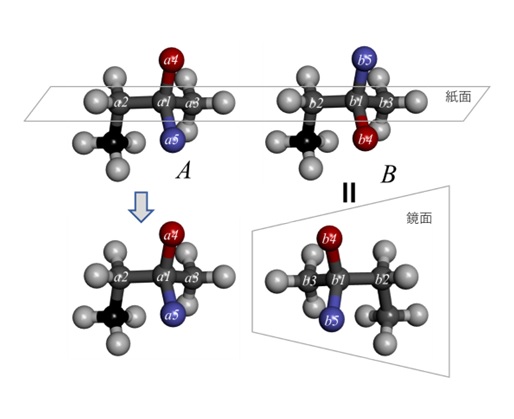
【図1 立体異性体】
3.二つの反応機構と共通点
(1)プロリン触媒の触媒反応機構
L-プロリン触媒によるアルドール反応の反応機構を図2に示します。6)
最初にケトン1がL-プロリンと反応してエナミン2を生成します。ベンズアルデヒド3が接近すると立体的に安定な9員環遷移状態4が優先的に生じます。再結合により5に変換され、加水分解で目的生成物である6に導かれ、同時に触媒であるL-プロリンが再生します。
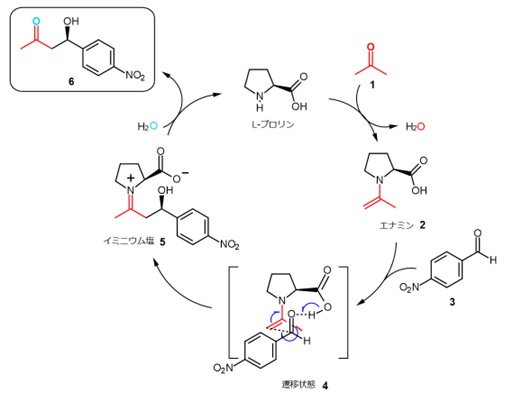
【図2 プロリンを触媒とする不斉アルドール反応】
もし立体配置が逆のD-プロリンを触媒として使用した場合、生成物の立体化学はどうなるでしょうか。
残念ながらD-プロリンを用いた同様の実験報告を見つけることはできませんでしたが、アミン触媒での検討が報告されています(式3)。7)
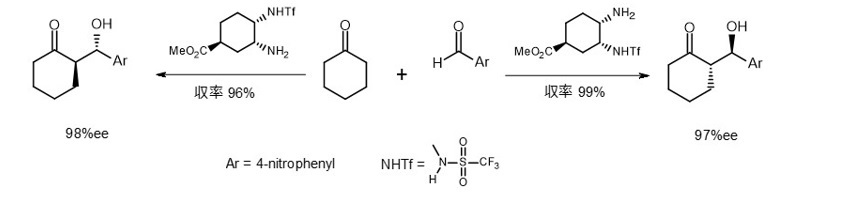
(式3)
生成物の立体化学は触媒の鏡像異性体に対応していることが証明されています。
ただし、触媒が異なる場合にも同様の結果が得られるとは限りません。
(2)イミダゾリジノン塩触媒の触媒反応機構
イミダゾリジノン塩触媒によるディールス・アルダー反応の反応機構を図3に示します。6)
最初にアルデヒド8が触媒7と反応してイミニウムイオン9を生成します。ここにジエン10が反応する場合、第3級ブチル基が嵩高いので、11bの配置より11aの生成が優先されます。11aは加水分解され、生成物12を与えるとともに触媒7が再生されます。
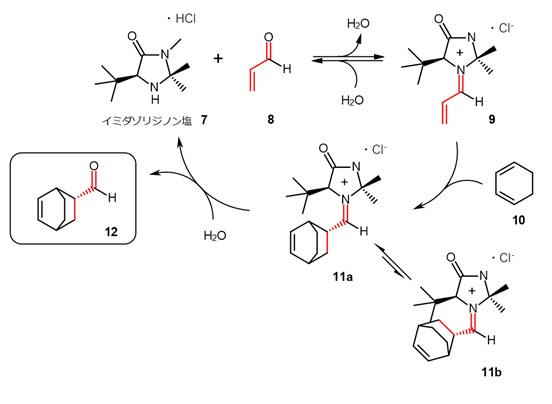
【図3 イミニウムイオンを触媒とする不斉ディールス・アルダー反応】
触媒はα-アミノ酸から容易に調製可能です。空気や水などに安定で、通常混ぜるだけで反応を進行させることができます。プロリンと同様、触媒量は多く必要とされることが難点です。
(3)有機分子触媒としての共通点
二つの触媒の大きな共通点を挙げてみます。
- 1) 基質の一方が反応性のあるカルボニル化合物(アルデヒドやケトン)に限られる
- 2) 不斉合成に多用されている錯体触媒のような金属を含まない有機物である
- 3) 多くの場合、金属触媒に比べて多量の触媒が必要である
不斉合成では反応中間体の立体特異的環境を用意するために、基質を触媒に固定する必要があります。
そこで基質を触媒と反応させる段階が必要となるため、基質の構造に制約が生じています。
図2および図3ではシッフ塩基を経由してエナミンやイミニウム塩を生成させています。
錯体触媒には鉛や水銀など高い毒性を示すものがありますが、生成物を精製してこれら金属濃度をppbレベルにするのは困難な場合があります。
また、金属錯体は水や空気に不安定なものも多く、取り扱いが煩雑になります。しかし、プロリンのように安価で容易に入手できる有機物はそのような煩雑さもなく、反応は基質と触媒を混ぜるだけで進めることができ、生成物からの除去も容易です(ppbレベルの精製を必要としない)。
一方、有機分子触媒では基質に対して高濃度の添加が必要になることが多いという欠点があります。
例えばListが初めて見出した式1の反応では基質に対して30%ものプロリンが使用されています。MacMillan触媒の場合も式2に見るように基質に対して5%の濃度です。
ただし、これらはその後の触媒構造の改良8)で大幅な濃度の削減(基質に対して0.05%以下)が達成されている例もあります。
4.触媒的不斉合成の研究動向(文献調査)
以下の条件でGoogle scholarでの検索をしてみました。結果を図1に示します。
- a : 引用部分を除く文献の全文中に「asymmetric」と「organocatalyst」を含むもの
- b : 上記同様の文献の全文中に「asymmetric」と「organometallic catalyst」を含むもの
- c : a/b
図1に示すように、a、b共に新規の報告数は増えており、不斉合成分野の研究が活発であることが窺われます。
aについては有機分子触媒が初めて報告された2000年以後の報告が飛躍的に増加しており、従来の有機金属錯体触媒による報告数に対する比率cでは、2008年までのaの増加率はbの増加率を凌いで伸び続けています。
2008年以降はa、b共に同じような動向を示すようになって、不斉合成における有機分子触媒の価値が、この時点で有機金属錯体触媒と同様に広く認識されたことを暗示させます。
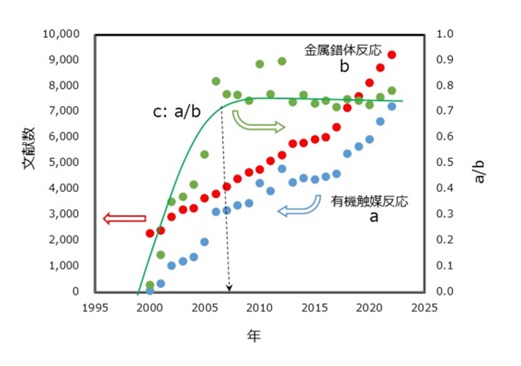
【図4 触媒的不斉合成の研究動向】
5.立体配置を考慮した化合物の命名法について
「有機分子触媒①」では鏡像体や鏡像体過剰率について解説しました。
ここでは、立体配置を考慮した化合物の命名法について簡単に触れておきます。
様々な命名法がありますが、最も多く使われている「S体/R体」について説明します。
図5および図6を参照しながら読み進めてください。
立体異性体は不斉炭素原子(C*;図6では「*」を付した原子)に注目して命名されますが、命名に大切な規則があるのでそれを列記します。
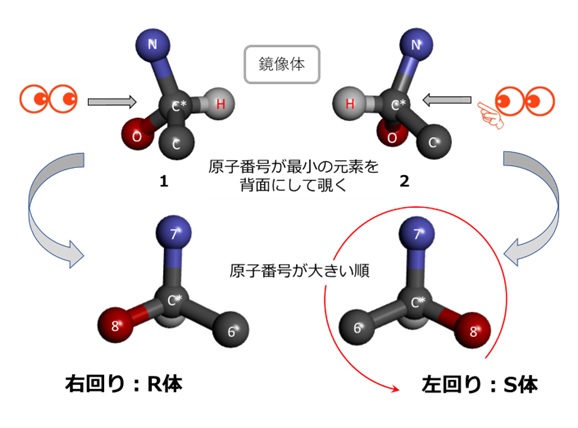
【図5 立体異性体の命名法(その1)】
- C*を見る方向から決めます。C*に結合している4つの原子の原子番号が最も小さいもの(図2では水素原子)を奥に置きます。
- 残りの3つの原子の原子番号を調べます。図2では炭素C(原子番号6)、窒素N(同7)、酸素O(同8)です。
- 最後に上記3つの原子番号が大きい順に円を描き、右回り1であればR体、左回り2であればS体と命名されます。
- 図3で上記1.を行います。この化合物のC*に結合するH以外の原子はC,C,Cで、回転の順序を決められません。その場合はこれらCが何に結合しているかを調べます。
- このとき、Cに多重結合で次の原子が結合している場合は結合次数個の原子が結合しているものと考えます。つまり、図3の3ではβの炭素が結合している原子は「C,H,H」、Χは「C,C,H」、δは「O,O,H」です。
- β、Χ、δの比較で、最も大きな原子番号Oがあるδが一番、次はCが2つあるΧ、最後がβの順で円を描く順番が決まります。右回りの化合物である3はR体、左回りの4はS体です。
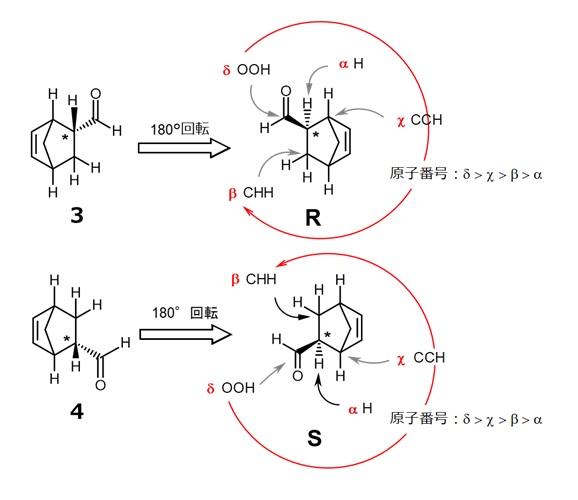
【図6 立体異性体の命名法(その2)】
6.有機分子触媒の改良研究
(1)プロリン型触媒の高活性・高選択性化
有機分子触媒は一般に活性が低いとされています。
高活性化に関する報告は多くありますが、以下に一例を記します。
プロリンは非常に有用な不斉触媒ですが、検討が進むに連れてプロリンでは鏡像体過剰率や反応性が低い例が知られるようになりました。
そこで様々な研究者の検討が加えられ、ジフェニルプロリノールシリルエーテル触媒7が提案され、現在では最も有効な触媒の一つになっています。
例えば、式4に示すアルデヒドとニトロアルケンとの反応において、プロリンと7を触媒として使用した場合の成績を比較しました。10)
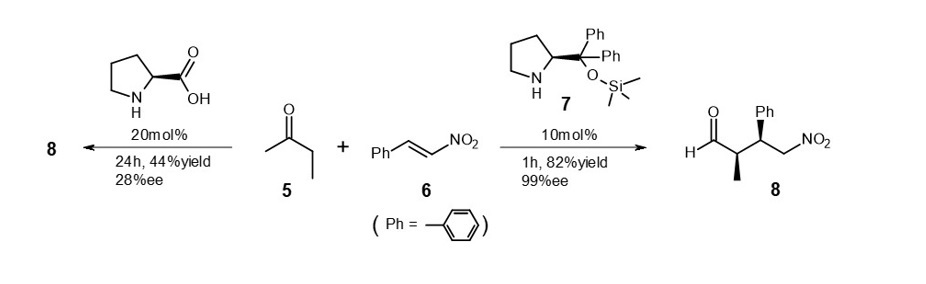
(式4)
触媒濃度に大きな削減はないものの、反応速度が大幅に向上しています。プロリン触媒による8の鏡像体過剰率は低いのですが、7触媒ではほぼ完璧な不斉合成が達成されています。
次に触媒濃度の低減化の例を紹介します。
初めて報告されたプロリン触媒によるアルドール反応の触媒濃度は基質に対して30mol%でした。
多くの場合、有機分子触媒は高濃度の触媒が必要と言われていますが、濃度の低減化を可能にした触媒が多数報告されるようになりました。6)

(式5)
式5の例では、プロリンのカルボン酸に代えてテトラゾールが使用されています。
テトラゾールはカルボン酸と同程度の酸性度で、カルボン酸の等価体として用いられます。
活性が向上したことによって、他の合成反応に有機分子触媒が適用できるようにもなりました。
その例として、α,β-不飽和カルボニル化合物へのニトロメタンの付加反応(マイケル付加反応)を式6に、環化付加反応を式7に示します。11) 12)
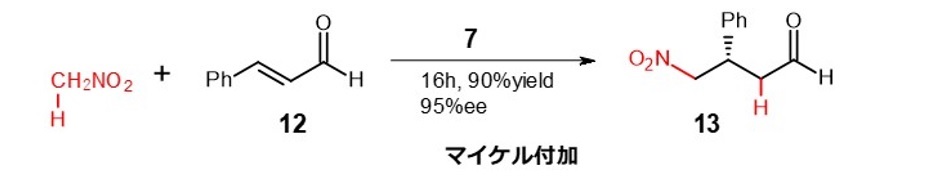
(式6)
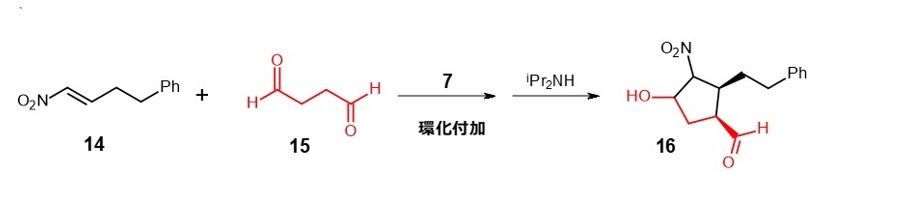
(式7)
これら改良された触媒は、天然物の全合成や生理活性物質合成の強力なツールとして認知されています。
(2)その他の有機分子触媒
現在ではアルドール反応やディールス・アルダー反応ばかりでなく、様々な不斉合成に有機分子触媒が使用されるようになりました。
とりわけ不斉合成で重要な反応としては、不斉付加反応と不斉水素化反応が挙げられます。
以下に代表的な触媒を示します。
① 不斉アルキル化 12)
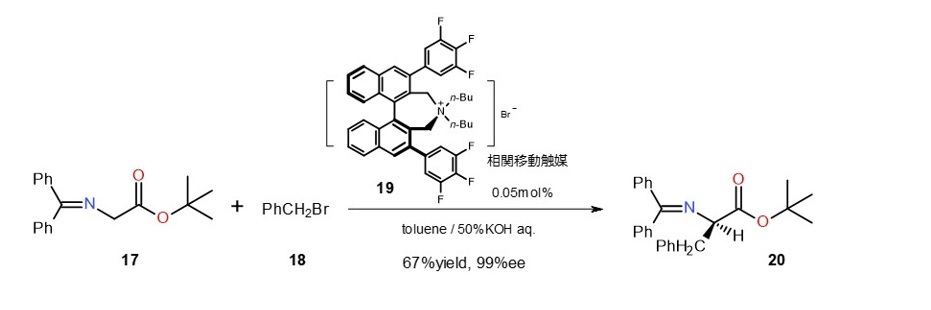
キラルな相関移動触媒19はグリシン誘導体17の不斉アルキル化に非常に有効です。
触媒は入手可能なビナフチルジカルボン酸から容易に合成できます。
触媒濃度も低く、鏡像異性体選択率も極めて高いので、これまで工業的に合成できなかった非天然アミノ酸が大量合成できるようになりました。
(式8)
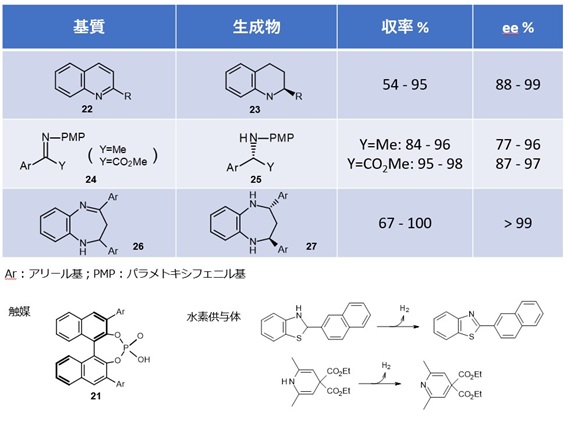
② 不斉水素化(水素移動型還元反応) 13)
自然界では補酵素である NADH が還元剤として機能することが知られています。アミン類を光学純度よく得る重要な手法にケトイミンの不斉還元があり、報告の多くは金属錯体を用いた例です。
表1にはキラルリン酸を触媒とし、水素供与体を水素源とする不斉還元反応のいくつかを例示しました。
この触媒は反応の適用範囲も広く、触媒調製も容易なので工業的価値が高いとみられています。
【表1 キラルリン酸による水素移動型還元反応 6)】
7.実用化を目指した研究~ 心不全の治療薬中間体の合成
有機分子触媒が工業規模で実用化されている可能性はありますが、詳細は不明です。
日本出願された特許は医薬や香料の中間体合成に関して複数あるので、その中から一つを紹介します。14)
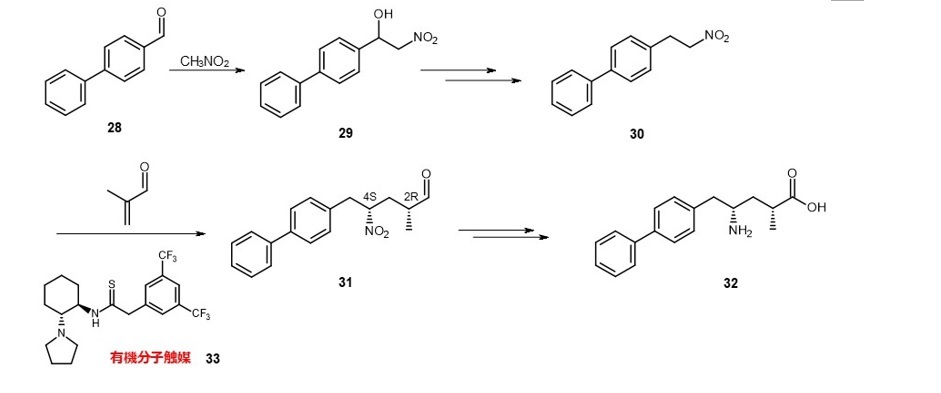
サクビトリルバルサルタンは心不全患者などに投与される降圧剤として使用されています。
その一成分であるサクビトリルの合成において、中間体30にメタクロレインを不斉付加させる際の触媒として33が提案されています。目的物31には2つの不斉炭素があり、立体異性体が4種類あります。
これら異性体に対する31の選択率は59%となっています。難度が高い不斉合成ですが、さらなる改良が望まれます(式9)。
(式9)
8.おわりに
ノーベル賞受賞者というような研究者は、目覚ましい成果を挙げ続けているのだろうと思いがちではないでしょうか?
しかしListは言います。9)
「2004年に比較的小さなグループを持っていましたが、ある分子がよい触媒になると確信しました。イースターの日曜日でした。誰も研究室にいなかったので、自分で作りました。Grignard反応とアセタール化が含まれていました。残念なことに、触媒はほとんど活性がありませんでした…。」
有機分子触媒は、ことに医薬原体およびその中間体を合成する手段として開発が進められています。
ListがL-プロリンという単純な天然アミノ酸を不斉触媒として用い、極めて高い鏡像体過剰率でアルドール付加体を得たことは、世界に大変な衝撃を与えました。その直後からこの分野の研究が活発になり、「有機分子触媒 Organocatalysts」という名称が与えられて20年が経ちました。医薬などの分野では既に実用化されている有機分子触媒があるものと推察されます。
有機分子触媒は学術的にも産業上も活発な検討が加えられ、さらに大きく発展すると思われます。
(アイアール技術者教育研究所 O・G)
《引用文献、参考文献》
- 1) 日経サイエンス「有機触媒で右手型・左手型作り分け 21年ノーベル化学賞」
https://www.nikkei.com/article/DGXZQOUC282VE0Y1A021C2000000/ - 2) https://pubs.acs.org/doi/pdf/10.1021/ja994280y
- 3) 北海道大学 リサーチタイムズ「ベンジャミン・リストさん、ノーベル化学賞受賞への想いとメッセージ」
https://www.hokudai.ac.jp/researchtimes/2021/12/post-43.html - 4) https://www.nobelprize.org/uploads/2021/10/popular-chemistryprize2021.pdf
- 5) https://pubs.acs.org/doi/pdf/10.1021/ja005517p
- 6) 五東弘昭「有機分子触媒を用いた不斉反応 ―プロリン誘導体を中心に―」
https://www.jstage.jst.go.jp/article/kakyoshi/66/10/66_500/_pdf - 7) 丸岡啓二「キラル有機分子触媒の複合化」
https://www.msd-life-science-foundation.or.jp/banyu_oldsite/sympo/sendai/2012/pdf/gist_maruoka.pdf - 8) 京都大学薬学研究科 丸岡研究室HP
https://www.pharm.kyoto-u.ac.jp/orgcat/research.html - 9) Chem-Station 海外化学者インタビュー 第53回―「革命的な有機触媒を開発する」Ben List教授
https://www.chem-station.com/interviews/reactions/2020/01/ben-list.html - 10) 戦略的創造研究推進事業 研究領域「低エネルギー、低環境負荷で持続可能なものづくりのための先導的な物質変換技術の創出」(ACT-C)研究課題「分子性酸触媒の設計」研究終了報告書
https://www.jst.go.jp/kisoken/archives/act-c/report/jst_1118100_12101724_yamamoto_per.pdf - 11) 関東化学株式会社「有機触媒を用いた生物活性化合物の全合成」
https://www.kanto.co.jp/dcms_media/other/CT_249_01.pdf - 12) 富士フイルム和光純薬株式会社「有機分子触媒の軌跡 -基礎から応用まで- 第2回 有機触媒の発展」
https://labchem-wako.fujifilm.com/jp/siyaku-blog/036365.html - 13) 秋山隆彦,有機合成化学協会誌,175巻,5号,410頁,2017年.
- 14) 特表2018-506541号(特許6665193号)











](https://engineer-education.com/wp/wp-content/uploads/2021/08/Experimental-design_0-150x150.jpg)
































