抗体医薬の高機能化技術を解説 [抗体薬物複合体(ADC)/二重特異性抗体/フラグメント抗体など]
抗体医薬に関する連載として、下記2回で抗体医薬の命名法をご紹介しながら基本的な知識を解説しました。
今回は、抗体医薬の効果を更に高めるための「高機能化技術」についてご紹介したいと思います。
目次
1.なぜ抗体の高機能化が必要か?
抗体医薬は、当初マウスを抗原分子で免疫することにより生成する物質である免疫グロブリンをそのままの形で医薬品として使用するものが中心でした。もちろん免疫グロブリンをそのまま使用しても十分な効果があるものもありますが、標的によっては期待したほど効果が上がらなかったり、投与量が多くなるために副作用や薬価の負担が大きくなってしまったりすることがありました。
そのため、抗体医薬の治療効果を更に高めるための様々な抗体医薬の改変・高機能化技術が開発されてきました。
今回は、代表的な以下の技術について事例を交えて解説します。
- 抗体薬物複合体
- 二重特異性抗体
- フラグメント抗体
- 糖鎖改変抗体
- アミノ酸置換抗体
2.抗体薬物複合体
抗体医薬は、目的の組織や細胞への選択性が高く、血中半減期が長いというメリットがある反面、分子量が大きく(約150 kDa)、細胞表面に存在する抗原にしか標的にできないという課題がありました。
一方、化学療法剤などの低分子医薬は、抗体と比較して選択性は低く血中半減期が短いものの、細胞内に取り込まれて細胞内のタンパク質もターゲットにできるという抗体医薬には無いメリットがあります。
そこで、抗体医薬に低分子医薬を化学的に結合させることで、抗体医薬と低分子医薬の両方の長所を生かしつつ、がん細胞を殺傷する効果を高めるために「抗体薬物複合体」(Antibody-Drug Conjugate; ADC)が開発されました。
ADCは図1で示す構造を有しています。
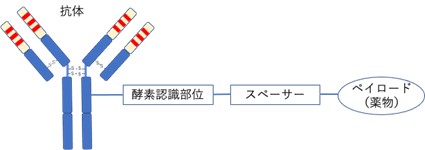
【図1 ADCの基本構造】
ADCは、血中では化学療法剤がリンカーを介して抗体に結合している状態になっていて細胞を殺傷する活性はありませんが、細胞内に取り込まれると細胞内の酵素の働きによってリンカー部分が切断されて化学療法剤が放出されます。
ADCの事例
① トラスツズマブ エムタンシン
- 商品名;カドサイラⓇ
- 特徴:抗HER2抗体であるトラスツズマブと化学療法剤であるDM1がリンカーによって結合している。
② トラスツズマブ デルクステカン
- 商品名;エンハーツⓇ
- 特徴:抗HER2抗体であるトラスツズマブと、トポイソメラーゼI阻害作用を有するカンプトテシン誘導体がリンカーによって結合している。
上記の薬剤はいずれも抗体としてトラスツズマブを使用していますが、リンカー部分の化学構造と化学療法剤が異なるために効果にも違いがあります。
第一三共社により2020年に開発されたエンハーツⓇは、抗体1分子あたりの化学療法剤の数が従来のADCと比較して多く(約8個)、トラスツズマブの標的分子であるHER2の発現が少ない癌にも効果が確かめられているなど、他の抗がん剤を繰り返し投与することで効かなくなってしまった薬剤抵抗性の癌に対する治療の選択肢として期待されています。
3.二重特異性抗体
前回の記事「抗体医薬の様々なターゲット」では、2種類の抗原に同時に結合することが可能な二重特異性抗体(バイスペシフィック抗体)の例として、血液凝固第IXa因子とX因子の両方に結合する血友病治療薬「エミシズマブ」(商品名:ヘムライブラ)を紹介しました。
二重特異性抗体のもう一つの事例として「二重特異性T細胞誘導抗体」(bispecific T-cell engager:BiTE抗体)が開発されています。BiTE抗体は、アムジェン社が開発したプラットフォーム技術で、がん細胞の抗原(CD19など)とT細胞の抗原(CD3など)のそれぞれに特異的な抗体の抗原結合部位を短いリンカーでつないだ一本鎖抗体(single chain variable fragment:scFv)と呼ばれる構造を有しています(図2)。
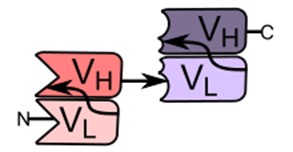
【図2 BiTE抗体の基本構造 ※引用1)】
ブリナツモマブ(一般名:ビーリンサイト)は、BiTE抗体技術をもとに開発されたB細胞性急性リンパ性白血病治療薬で、がん細胞(B細胞)とT細胞をブリナツモマブが架橋することで免疫反応を誘導します。
4.フラグメント抗体
天然の抗体である免疫グロブリンは、可変領域を含むFabとFcと呼ばれる2つのフラグメントから構成されます(図3)。
このうち、パパインやペプシンなどの消化酵素による切断によって生成するFab断片あるいはFc断片のみからなる抗体を「フラグメント抗体」と呼びます。特に、Fab断片は、天然の免疫グロブリンと比較して分子量が小さいために組織への移行が容易となることや、Fc領域が細胞表面に存在するFc受容体に結合してしまうという非特異的な結合を回避できるというメリットがあります。
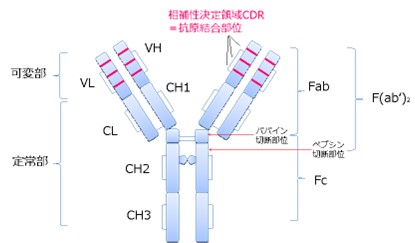
【図3 BiTE抗体の基本構造 ※引用2)】
フラグメント抗体の代表的な例として、ラニビズマブ(商品名:ルセンティス)は、血管内皮増殖因子A(VEGF-A)に結合するモノクローナルで、滲出型加齢黄斑変性症などの網膜の加齢性疾患の治療に用いられる薬です。この薬は目の硝子体と呼ばれる部分に直接注射して使用する製剤となっていますが、全長の免疫グロブリンでは網膜への移行性があまり良くないので、より分子量の小さく移行性が高いFab断片として開発された経緯があります。
5.糖鎖改変抗体
抗体は、H鎖のFc領域のアスパラギン(Asn)残基に「糖鎖」が結合している「糖タンパク質」の一種です。
この糖鎖の構造の違いが抗体としての活性や動態に影響することが知られています。
協和発酵キリン社のプラットフォーム技術であるPOTELLIGENT®(ポテリジェント)技術では、糖鎖を構成する糖の1つである「フコース」を除去することにより、通常の抗体と比較して細胞殺傷能力を100倍以上に強化することを可能にしています。
同社がポテリジェント技術を応用して開発したモガムリズマブ(商品名:ポテリジオ)は、一部のT細胞リンパ腫で過剰に発現しているケモカイン受容体のCCR4に結合するヒト化モノクローナル抗体で、抗体依存性細胞傷害(Antibody-Dependent Cellular Cytotoxicity: ADCC)活性により高い抗腫瘍効果を示すことが確認されています。
6.アミノ酸置換抗体
抗体医薬の一部では、天然の免疫グロブリンのアミノ酸の一部を改変して高機能化する技術が採用されています。
中外製薬社のプラットフォーム技術である「リサイクリング抗体®」技術では、アミノ酸置換の手法により、通常では抗原に一回しか結合できずに最終的に細胞内に取り込まれて分解されてしまう運命にある抗体を何度でも「リサイクル」することを可能にしています。
同社が開発したサトラリズマブ(商品名:エンスプリング)は、関節リウマチなどの自己免疫疾患を適応とする抗IL-6受容体抗体のトシリズマブ(商品名:アクテムラ)のCDR領域のアミノ酸をチロシンから塩基性アミノ酸のヒスチジンに置換したものです。
IL-6受容体と一度結合した抗体がエンドソーム内に移行すると、エンドソーム内の酸性(約pH6.0)の環境でヒスチジンの電荷が変化することによってIL-6受容体と解離して、再度別のIL-6受容体と結合することが可能になっています(図4)。
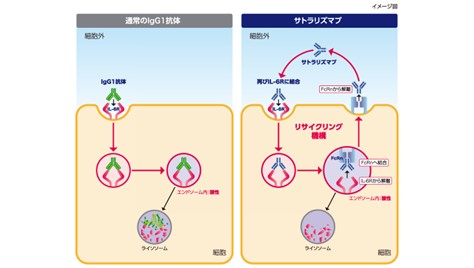
【図4 サトラリズマブのリサイクリング機構模式図 ※引用3)】
サトラリズマブは、リサイクリング抗体技術を採用することで、従来のトシリズマブと比較して投与間隔が延長され、1ヶ月に1回の皮下注射で効果が得られるようになっています。
7.進化を続ける抗体医薬
以上、最先端のバイオ技術を駆使して開発された「次世代型」の高機能化抗体医薬を解説しました。
当初は私たちの身体の中にもある免疫システムをそのまま応用していた抗体医薬ですが、これからも画期的な新しいバイオ工学技術が生み出されることによって、抗体医薬も更なる進化を続けていくものと思われます。
次回は、抗体医薬/バイオ医薬のジェネリック医薬品である「バイオシミラー」について解説します。
(アイアール技術者教育研究所 A・S)
《引用文献・参考文献》
- 1)Wikipedia 「二重特異性T細胞誘導抗体」
- 2)国立医薬品食品衛生研究所 生物薬品部(Webサイト)
http://www.nihs.go.jp/dbcb/mabs.html - 3)中外製薬株式会社(Webサイト)
https://chugai-pharm.jp/contents/ca/027/(※医療関係者向けページとなります)






](https://engineer-education.com/wp/wp-content/uploads/2022/09/experimental-design_statistics_1-150x150.png)
































