マイクロバイオーム創薬の基礎知識と特許に関する注意点
目次
1.マイクロバイオームとは?
「マイクロバイオーム」とは、細菌叢を指す用語です。
これまでに腸内細菌叢の乱れ(ディスバイオーシス)が、様々な疾患と関連していることが明らかになっています。
マイクロバイオーム医薬は、このような疾患の治療や予防のためにヒトの細菌叢を標的とする医薬を指します。そのため、本来マイクロバイオーム医薬は、プロバイオティクス、プレバイオティクス、抗生物質、ファージ療法などの幅広い概念を含みますが、本コラムでは、医薬品として開発されているプロバイオティクス、すなわち米国FDAで「Live Biotherapeutic Products(LBPs)」と総称されるマイクロバイオーム医薬にフォーカスし、近年の動向と特許上の問題について説明します。
2.マイクロバイオーム医薬の開発状況
従来から、食品産業を中心にヒトの腸内マイクロバイオームと健康の関係について一定の研究や啓蒙が行われていました。しかし、2010年代にC.difficile感染症(CDI)患者に対するFMT(糞便微生物移植: Fecal Microbiota Transplant)の臨床的な有効性が報告されたことなどを契機に、マイクロバイオーム医薬の研究開発が活発化しました。
その後、2023年にはFerring Pharmaceticals社の腸内投与型のREBYOTA、続いてSeres Therapeutic社の経口投与型のVOWSTといったFMTベースの製剤がFDAなどで承認され、これらを皮切りにマイクロバイオーム創薬の本格的な競争が表面化しています。
[※関連記事:3分でわかる技術の超キホン 糞便微生物移植(FMT)とは?]
2.マイクロバイオーム医薬の対象疾患
現在、各国で開発が進行中のマイクロバイオーム医薬の対象疾患は、CDIなどの感染症、がん、炎症性腸疾患などの胃腸疾患、糖尿病や高グリセリド血症などの代謝性疾患、パーキンソン病やうつ病などの中枢神経疾患、アトピー性皮膚炎などの皮膚疾患など非常に幅広いです。
これらの疾患は、ディスバイオーシスを原因とするもの、あるいはディスバイオーシスが原因で既存治療の効果が十分に発揮されていないものです。マイクロバイオーム医薬によって健全な腸内細菌叢を再構築することで、疾患の改善や既存治療の効果向上が期待されています。
4つ以上のパイプラインを持つマイクロバイオーム医薬を開発する主な企業と対象疾患の概略を示します。(表1)
【表1 マイクロバイオーム医薬を開発する主な企業と対象疾患の概略】
| SERES THERAPEUTICS | C. difficile感染症_FDA承認済 |
| 他の感染症 | |
| 免疫系疾患(移植片対宿主病) | |
| がん | |
| 胃腸疾患(潰瘍性大腸炎) | |
| CJ BIOSCIENCE | がん |
| 胃腸疾患(炎症性大腸炎) | |
| 中枢神経疾患(パーキンソン病) | |
| 呼吸器疾患(喘息) | |
| VEDANTA BIOSCIENCES | C. difficile感染症 |
| 他の感染症 | |
| 胃腸疾患(炎症性大腸炎) | |
| NuBIYOTA | C. difficile感染症 |
| 胃腸疾患(潰瘍性腸疾患) | |
| 代謝性疾患(高トリグリセリド血症等) | |
| 中枢神経疾患(うつ、不安) | |
| MaaT Pharma | 免疫系疾患(移植片対宿主病) |
| がん | |
| 中枢神経疾患(ALS) |
3.マイクロバイオーム医薬の種類(分類)と特徴
FDAで「LBPs」と総称されるマイクロバイオーム医薬は主に3種類に分類されます。
(1)FMT(糞便微生物移植:Fecal Microbiota Transplant)
FMTベースの製剤は、健康なドナーの糞便に由来する細菌叢を製剤化したものです。
FMTはマイクロバイオーム医療の先駆けとして、既に複数の国で難治性CDIに対する標準治療法となっており、また上述したとおり、製剤としてもFDAなどで承認され、今後のさらなる疾患への拡大が期待されています。
しかし、FMTベースの製剤はドナー由来であるため、安全性や規格化の問題に加え、原料の調達元となる健康なドナーの確保が必要となるため、製造・品質管理に課題があります。
(2)細菌コンソーシアム
細菌コンソーシアムベースの製剤は、健康なドナーの糞便などから分離された複数の培養細菌株を組み合わせたものです。
培養細菌株を使用するため、FMTのような製造・品質管理の問題はありませんが、一般的に嫌気性細菌を用いることから、GMP条件下での製造には大幅な最適化が必要です。
また、複数の培養細菌株は、多くの場合FMTなどの研究によって得られた知見に基づき、疾患に応じた所望の生物学的機能によって選択されますが、必ずしも定着性や薬効が十分であるとは限りません。
(3)単一細菌株
単一細菌株ベースの製剤は、単一の分離細菌または遺伝子改変細菌を使用したものです。
製造・品質管理の面では最も容易ですが、単一細菌株であるため、定着性や薬効が十分でない可能性があります。また、遺伝子改変細菌についてはカルタヘナ議定書に基づく各国の規制を考慮する必要があります。
4.マイクロバイオーム医薬の特許上の問題点
(1)特許出願が急増している
マイクロバイオーム医薬関連の特許は、従来は食品分野を中心に組成物特許や用途特許として一定数出願されていました。しかし、下のグラフのとおり、難治性CDIに対するFMT治療の有効性が報告された2013年頃から、マイクロバイオーム関連特許の出願件数は急増しています。
論文数についても増加傾向が見られます。
【表2 マイクロバイオーム関連特許の出願件数の推移
(全世界/ファミリー毎)】
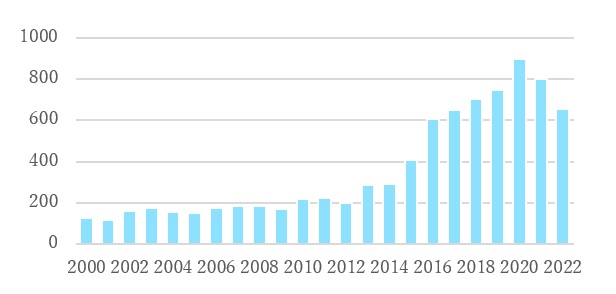
このようなマイクロバイオーム関連特許の中には、CDIなど特定疾患の治療用組成物として具体的な種や株単位で規定された特許や、以下のように多様な疾患に対してクラスター単位または属単位などで規定された広い権利範囲を持つ特許も成立しています。
特許6115971号
【特許請求の範囲】
【請求項1】
自己免疫疾患、炎症性疾患又は感染症の治療用組成物であって、下記(a)〜(b)からなる群より選択される2以上の細菌を有効成分とする、制御性T細胞の増殖または集積を誘導する組成物
(a) ヒト由来のクロストリジウム クラスター14aに属する細菌
(b) ヒト由来のクロストリジウム クラスター4に属する細菌。
特許6884889号
【特許請求の範囲】
【請求項1】
パーキンソン病・・・アルツハイマー病・・・認知症・・・の治療もしくは予防方法に使用するための、ロゼブリア(Roseburia)属の細菌株を含む組成物。
このように様々な権利範囲を持つ多くの特許に対する侵害を避け、将来的な事業の発展性や継続性を確保するために、なるべく早い段階で自社製品の展開を予定している国で出願・成立している特許を調査し、何らかの対策を講じる必要があります。
(2)FMTベースの製剤は特許侵害の回避が困難?
通常の医薬品開発では、侵害する可能性がある特許が存在する場合、特許の構成を含まないように製品設計をすることで、侵害を回避できることがあります。
例えば、X分子に対する抗体医薬の特許が「配列番号1に示されるアミノ酸配列の重鎖CDR-H1の配列を含む、抗X分子抗体」である場合、抗X分子抗体を、配列番号1のアミノ酸配列の重鎖CDR-H1の配列を含まないように設計すれば、原則この特許に対する侵害を回避できます。
しかし、FMTベースの製剤はドナー由来の雑多な細菌種を製剤化しており、その中から特許に規定された特定の細菌を製造工程で除去、分画することは現実的に困難であることが想定されます。
そのため、「細菌A、B及びC種を含む、CDI治療用組成物」といった、一見すると、それほど広くない権利範囲を持つ特許であっても、ヒト糞便中に細菌A、B及びC種が普遍的に存在する場合、CDI治療用のドナー糞便中にこれらの細菌が含まれる可能性が高く、製剤化の過程で除去等ができない以上、特許の侵害を回避することは難しいと考えられます。
回避できない場合は、ライセンス取得や特許の無効化などの対策が必要になります。
特許存続期間や特許権者の性質に応じて、具体的な対策の内容が変わるため、まずは侵害の可能性がある特許を特定する調査が不可欠です。
(3)特許取得の難しさ
マイクロバイオーム医薬の研究開発では、遺伝子改変細菌等の開発を除き、一般的にはドナー糞便中の細菌叢と、投与前後のレシピエントの細菌叢や生体反応の変化等のデータを解析し、治療に寄与し得る細菌を同定するトップダウン型の研究開発が考えられます。
しかし、上述のように、現在では数多くの特許や論文が公開されているため、このようにして同定された腸内細菌そのものは既知であり、特許上の新規性がない場合が多いです。また、特定疾患に対して治療効果を持つ細菌叢のメタデータが公開されていれば、進歩性も否定されやすくなります。
そのため、ある程度の広さを持つ特許を取得するには、例えば新たな対象疾患の発見、既知の対象疾患での新たな特定集団(レスポンダー)の発見、新たな治療メカニズムの発見など、先行特許・論文に対して新規性や進歩性を主張できる実験データの取得になんらかの工夫が必要です。
仮に、新たな対象疾患で一定の広さを持つ特許を取得することができれば、同疾患での後続参入が困難になるため、自社製品の保護に加え、他社との協業やクロスライセンスといった選択肢を得ることができ、事業上の優位性を確保できる可能性が広がります。このような特許取得のためには、適切な先行技術調査を実施することが重要となります。
その他、マイクロバイオーム医薬の特許上の注意点として各国での特許要件の違いなど種々の問題がありますが、特許実務よりのテーマですので本稿では割愛します。
バイオ技術の特許は、技術や権利内容の理解が難しいケースも多いため、バイオ関連特許について高度な知見を持つ特許事務所や特許調査会社などに相談されることをお勧めします。
5.バイオ医薬に関する調査とセミナー情報
当サイトを運営している日本アイアールは特許調査・技術調査をコア業務としており、バイオ医薬関連技術についても専門性の高いサーチャーチームが対応しています。
ニーズに応じて最適な調査プランをご提案しますので、お気軽にお問い合わせ下さい。
また当サイトにおいて、バイオ医薬分野に関連する技術セミナー、法律・知財・薬事に関するセミナーも多数ご紹介しております。ご興味がある方は是非チェックしてください。
 《この記事の執筆者》
《この記事の執筆者》
木羽 邦敏(弁理士)
ランフォード国際特許事務所 代表
日本アイアール株式会社 バイオ調査コンサルタント
《引用文献、参考文献》
- 1) Van Nood, E. et al. Duodenal Infusion of Donor Feces for Recurrent Clostridium difficile, N Engl J Med; 368:407-415, 2013
- 2) 金 倫基、中原 拓、腸内細菌叢を標的とした医薬品開発、日経バイオテク、2023
- 3) MJ FitzGerald. Microbiome therapeutics and patent protection, Nature Biotechnology;38; p806–810, 2020
- 4) Emily L Gulliver. et al. Review article: the future of microbiome-based therapeutics, Aliment Pharmacol Ther; 56(2) :192-208,2022











































