GLP-1受容体作動薬の開発競争と特許の攻防について解説 [イーライリリー社vsノボノルディスク社]

GLP-1受容体作動薬(以下、GLP-1RA)市場は、オゼンピックなどII型糖尿病治療薬や肥満症治療薬として注目される一方で、イーライリリー社とノボノルディスク社による激しい開発競争と特許戦略の舞台となっています。
本稿では、両社のGLP-1RA開発の歴史を主に米国及び日本特許の観点から解説し、その攻防の軌跡をご紹介します。
[※関連記事:GLP-1受容体作動薬の基礎知識はこちらをご参照ください]
目次
1.GLP-1の発見と初期の特許状況
GLP-1(Glucagon-like peptide-1)のII型糖尿病治療薬としての可能性は、1985年頃、Joel Habener博士らがGLP-1(7-37)などを単離し、そのインスリン分泌効果を発見したことから始まりました1)、2)。
この発見を基に、マサチューセッツ総合病院が1985-90年頃にかけて特許出願を行い(WO87/06941A1、WO90/11296A1等)、GLP-1、その類似体(アナログ)、及びこれらを用いたII型糖尿病治療に関する基本特許を各国で取得しました3)、4)、5)。
これらの発見と基本特許が、後のGLP-1RA開発競争の基盤となりました。
しかし、天然のGLP-1は、血中での半減期が約2分と短く、そのまま投与してもすぐに分解されてしまうため、治療薬として利用できません。そこで、長い半減期を持ち、高い効果を有するGLP-1RAの開発が、主にイーライリリー社とノボノルディスク社を中心に進められてきました。
その発展の概要を図1に示します。
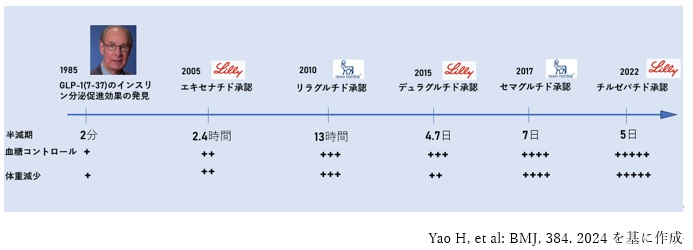
【図1 GLP-1の発見と、イーライリリー社及びノボノルディスク社による各GLP-1RAの特徴】
2.イーライリリー社の初期の優位性
(1)エキセナチドの開発(2005年)
当初イーライリリー社は、GLP-1アナログでの臨床試験を進めていましたが、途中から、アメリカドクトカゲの唾液から発見されたペプチド(エキセンディン-4)を基にした「エキセナチド」の開発に注力しました8)。
エキセナチドは、図2に示すように、GLP-1の分解酵素であるDPP-4(Dipeptidyl Peptidase-4)によって切断される8位のAがGに置換され、29位から39位で形成される3次元構造によって他の酵素からの分解を防ぐことができます。
また、GLP-1受容体の活性化に不可欠なN末端の配列が保存されています。
このような配列によって半減期は2.4時間となり、また天然のGLP-1よりも高い効果を示します9)。
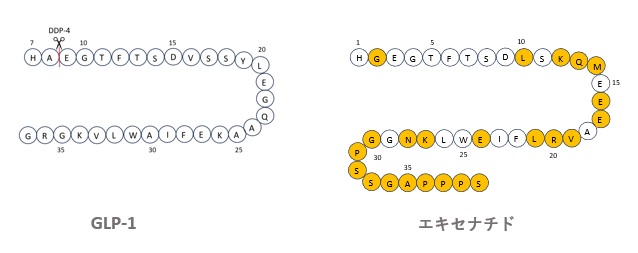
【図2 GLP-1とエキセナチドのアミノ酸配列の比較】
エキセナチドは、GLP-1との相同性が約56%であるため、先行するマサチューセッツ総合病院のGLP-1基本特許を回避しながら、自由に販売等できる利点がありました。
エキセナチドの物質特許は、発見者であるJohn Eng博士によって取得され10)、後にイーライリリー社とアミリンファーマシューカルズ社が譲り受け11)、その後の開発を進めました。この戦略により、イーライリリー社らは、2005年にエキセナチド(Byetta)を初のGLP-1RAとして、米国で承認を得ることに成功しました。
エキセナチドの物質特許は、上述のとおりJohn Eng博士の個人出願であり、特許資金の捻出が困難であったため、表1に示すとおり、米国だけで出願され、成立しています。なお、現在、エキセナチド(Byettaなど)は、アストラゼネカ社が販売権などを保有しています。
【表1 エキセナチドの日米における物質特許及び承認の状況】
| 有効成分 | 日米物質特許 | 商品総称名 | 適応/日米承認の有無 |
| エキセナチド | 日本特許なし US5424286(満了) |
Byetta/バイエッタ | II型糖尿病/日-米 |
| Bydureon/ビデュリオン | II型糖尿病/日-米 |
3.ノボノルディスク社の反撃/脂肪酸修飾アプローチ
(1)リラグルチドの開発(2010年)
ノボノルディスク社は、イーライリリー社とは異なり、GLP-1に可能な限り近いアナログを使用し、そこに脂肪酸を修飾するアプローチによって「リラグルチド」を開発しました12)。
脂肪酸を修飾することで、生体で長期安定的に循環する血清アルブミンにGLP-1を結合させることができ、これにより分解酵素DPP-4が作用できず、GLP-1の切断を防ぐことができます13)。
リラグルチドは、図3に示すようにGLP-1の26位のK残基にγGluスペーサーを介してC-16脂肪酸が修飾された構造を持ち、この構造によって半減期が約13時間となり、エキセナチドよりも高い効果を示します。
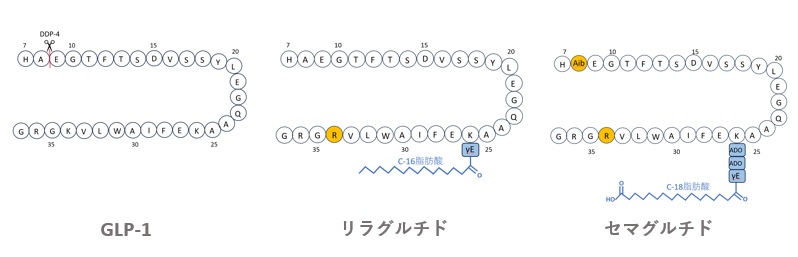
オレンジ色はGLP-1と異なるアミノ酸配列、青色はスペーサー及び脂肪酸を示す。
【図3 GLP-1、リラグルチド及びセマグルチドの構造比較】
脂肪酸修飾アプローチのコンセプトは、例えばアイオワ大学によるWO92/001476A1で開示されていますが、特許として成立していません。
一方で、リラグルチドのGLP-1部分は、天然のGLP-1に対し34位のみ異なる配列(K34R)を持ち、マサチューセッツ総合病院の特許US5545618などの権利範囲に含まれるため、共有特許権者であるサイオス社からライセンスを受けて開発を進めたようです14)。
ノボノルディスク社は、脂肪酸修飾アプローチに関して、表2に示す物質特許以外にも、例えばGLP-1のC末端の親油性置換(US7576059)やエキセナチドの親油性置換(US7226990)など、様々な角度から権利化を行っています。
それに加えて、広範な権利範囲を持つ修飾医薬化合物に関する特許(US6342225)を譲り受けるなどして、脂肪酸修飾アプローチについて多重の保護を図っていたことが伺えます。
(2)セマグルチドの開発(2017年)
ノボノルディスク社は、さらに改良を重ね、「セマグルチド」を開発しました。
セマグルチドは、図3に示すように、GLP-1のA8Aib及びK34Rの置換が加えられ、26位のKが2つのADO(8-アミノ-3,6-ジオキサオクタン酸)とγ-Gluからなるスペーサーを介してC18脂肪酸で修飾された構造を持ちます。この改良により、血清アルブミンへの親和性とGLP-1受容体への効力が増強され、半減期は7日に延び、週1回の投与でリラグルチドよりも高い効果が得られるようになりました8)。
表2に示すとおり、リラグルチドの物質特許は満了しましたが、セマグルチドの主な物質特許は日米ともに2030年前後の満了予定であり、ブロックバスターのオゼンピックを中心とする現在のGLP-1RA市場でノボノルディスク社に強力な競争優位性をもたらしています。
【表2 リラグルチド及びセマグルチドの日米における物質特許及び承認の状況】
| 有効成分 | 日米物質特許 | 商品総称名 | 適応/日米承認の有無 |
| リラグルチド | 特許3149958(満了) US6268343(満了) US6458924(満了) US7235627(満了) |
Victoza/ビクトーザ | II型糖尿病/日-米 |
| Saxenda | 肥満症/米 |
| 有効成分 | 日米物質特許 | 商品総称名 | 適応/日米承認の有無 |
| セマグルチド | 特許4585037(2031/3/20満了予定) 特許4949838(2029/9/17満了予定) 特許5209463(2031/3/20満了予定) US8129343(2031/12/05満了予定) US8536122(2026/03/20満了予定) |
OZEMPIC/オゼンピック | II型糖尿病/日-米 |
| RYBELSUS/リベルサス | II型糖尿病/日-米 | ||
| WEGOVY/ウゴービ | 肥満症/日-米 |
*表2-4の日本特許の満了予定日は、特許庁データベースJ-platpatで確認した延長登録を反映した予定日です。Google patentの満了予定日(Anticipated expiration)は、日本特許の延長登録が反映されていない場合があることにご留意ください。
4.イーライリリー社の巻き返し
(1)デュラグルチドの開発(2015年)
イーライリリー社は、エキセナチドの次の製品として、GLP-1アナログと免疫グロブリンFc(IgG4-Fc)フラグメントを融合させたFc融合体の「デュラグルチド」を開発しました。
Fcフラグメントは、血清アルブミンと同様に、血中で長期安定的に循環でき、Fc融合化することで、分解酵素DPP-4などが立体障害により、GLP-1部分に作用できないため、切断を防ぐと考えられています9)。
デュラグルチドは、図4に示すように、GLP-1部分、スペーサー、及びFcフラグメントの順で構成されるホモ二量体融合ペプチドです。GLP-1部分は、切断耐性などを付与するためのA8G、G22A、及びT細胞エピトープとの相互作用を回避するためのR36Gの置換を含み、Fcフラグメント部分には、Fcγ受容体との結合や、半量体形成を抑制するためのS228P、F234A、L235Aの置換を含んでいます15)。
デュラグルチドの半減期は約4.7日であり、週1回の投与でリラグルチドよりも高い血糖コントロール効果を有します。
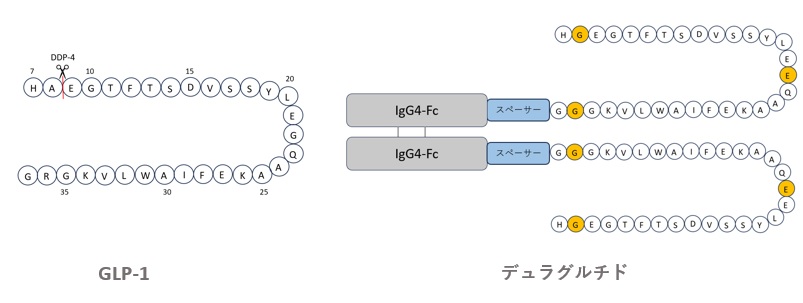
オレンジ色はGLP-1と異なるアミノ酸配列、青はスペーサー、灰色はFcフラグメントを示す。
【図4 GLP-1とデュラグルチドの構造比較】
Fc融合体のコンセプトは、例えば、ジェネンテック社のUS5428130Aで、受容体- Fc融合体として開示されています。しかし、GLP-1などのリガンド-Fc融合体のコンセプトで成立している先行特許の存在は確認できません。さらに、デュラグルチドのFcフラグメントに含まれるS228P、F234A及びL235Aのいずれかの置換を含むFcフラグメントを規定した先行特許の存在も確認できません16)、17)。そして、デュラグルチドのGLP-1部分の配列も、イーライリリー社のWO05/000892A2で初めて開示されたオリジナル配列です。
したがって、Fc融合体を使用したデュラグルチドは、イーライリリー社が自由に販売等できる領域であったと考えられます。
表3に示すとおり、デュラグルチドを保護する主な物質特許は日米で2027~2029年に満了する予定です。
【表3 デュラグルチドの日米における主な物質特許及び承認の状況】
| 有効成分 | 日米物質特許 | 商品総称名 | 適応/日米承認の有無 |
| デュラグルチド | 特許4629047(2029/1/23満了予定) US7452966(2027/12/7満了予定) |
Trulicity/トルリシティ | II型糖尿病/日-米 |
(2)チルゼパチドの開発(2022年)
イーライリリー社は、その後、図5に示すように、GLP-1、GIP(Gastric inhibitory polypeptide)及びエキセンディン-4骨格のハイブリッド構造を持つ、初のGLP-1/GIP受容体二重作動薬である「チルゼパチド」を開発しました。
チルゼパチドには、脂肪酸修飾が加えられ、半減期が約5日であり、GLP-1/GIP受容体との二重作動により、現在上市されているGLP-1RAの中で最も高い効果を有します。
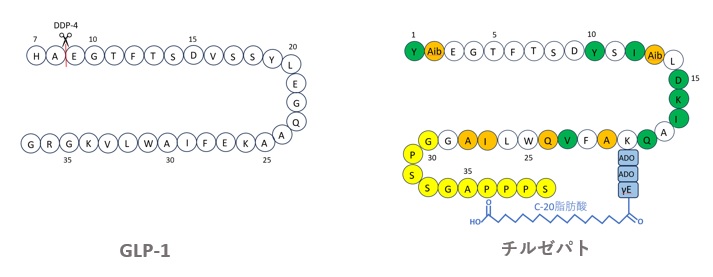
オレンジ色はGLP-1及びGIPと異なる配列を、緑色はGIPのみに含まれる配列を、
黄色はエキセナチドに含まれる配列を、青色はスペーサー及び脂肪酸を示す。
【図5 GLP-1とチルゼパチドの構造比較】
チルゼパチドの配列と脂肪酸の修飾位置などはWO16/111971A1で公開されています。
興味深いことに、チルゼパチドの脂肪酸修飾は、C20脂肪酸を採用していること以外は、ノボノルディスク社のセマグルチドと対応する同じ位置(K)に、同じスペーサーを介して配置されています。これは、ノボノルディスク社が保有していた一部の脂肪酸修飾関連特許が消滅したことに加え、チルゼパチドでハイブリッド骨格を採用したことにより、ノボノルディスク社が保有する、GLP-1骨格やエキセナチド骨格などを中心に規定された脂肪酸修飾特許を回避できたことによるものと考えられます。
チルゼパチドを保護する物質特許は、表4に示すとおり、日米ともに2036年~2040年に満了する予定であり、その効果の高さから、イーライリリー社に長期的な市場優位性をもたらす可能性があります。
なお、チルゼパチドに関する物質特許は、2024年7月時点では未だ各国で権利化の途上にあり、今後増える可能性があります。また、表中の米国特許(US9474780)についても、FDAに特許期間の延長申請がなされていますが、現在審査中のため、今後満了期間が変更される可能性があります。
【表4 チルゼパチドの日米における主な物質特許及び承認の状況】
| 有効成分 | 日米物質特許 | 商品総称名 | 適応/日米承認の有無 |
| チルゼパチド | 特許6219534号(2040/11/24) US9474780(2036/01/05) |
Mounjaro/マンジャロ | II型糖尿病/日-米 |
| Zepbound | 肥満症/米 |
5.肥満症治療薬開発における攻防
GLP-1RAの肥満症治療への応用は、II型糖尿病治療薬とは別の歴史が存在します。
ここで、1996年に遡り、肥満症治療薬開発の攻防を見ていきましょう。
(1)イーライリリー社の初期の優位性
イーライリリー社は1996年にGLP-1の体重減少効果を発見し、特許出願を行いました(WO98/19698A1(最先優先日:1996/11/05))。
この特許出願は、ノボノルディスク社の食欲抑制効果に関する特許出願よりわずか1週間早かったため(WO98/20895A1(最先優先日:1996/11/12))、イーライリリー社は、米国特許US6583111(以降「111特許」という)などのGLP-1RAを使った肥満治療に関する広い用途特許を成立させることに成功しました。
一方、ノボノルディスク社は、米国ではイーライリリー社の特許出願などを基に拒絶され、肥満治療に関する広い特許の成立に失敗しました。
(2)ノボノルディスク社の巻き返し
しかし、当時のイーライリリー社は、「肥満」を疾患として見ておらず、特許による市場独占権を得たにもかかわらず、2003年頃から肥満症治療薬の研究を一時的に完全に停止し、この分野でノボノルディスク社に大きく遅れを取ることになりました18)。
これに対し、ノボノルディスク社は着実に研究を進め、上述したリラグルチド(Saxenda /2014年)及びセマグルチド(Wegovy/2021年)で肥満症治療薬として追加の承認を得ました。
なお、Saxenda の米国承認及び販売時点では、イーライリリー社の111特許(2017/10/30満了)は存続していましたが、イーライリリー社からの特許侵害訴訟の提起は確認されていません。
さらに、ノボノルディスク社は、111特許の満了後に販売を開始したII型糖尿病治療薬のオゼンピック(セマグルチド)のコマーシャルなどで、体重減少効果を全面に押し出し19)、インフルエンサーなどの影響も相まって、オゼンピックの適用外処方が問題視されるレベルにまで、オゼンピックによる体重減少効果が大衆に周知されました20)、21)。オゼンピックのブロックバスターとしての地位は、少なからずこのような側面にも支えられているようです。
その後、イーライリリー社は、GLP-1/GIP受容体二重作動薬であるチルゼパチドのII型糖尿病治療薬(Mounjaro)の開発に成功し、2023年に肥満症治療薬(Zepbound)として追加の承認を得て、その効果の高さを武器に巻き返しを図ろうと猛追しています。
6.まとめ《研究開発と特許戦略の連携》
GLP-1RA市場におけるイーライリリー社とノボノルディスク社の攻防から、創薬における研究開発と特許戦略を連携させることの重要性が見えてきます。
両社は互いの特許や他社特許を回避しつつ、独自技術を開発し、市場でのポジションを確立してきました。
本事例をまとめると以下のポイントが重要になります。
- 特許状況の徹底的な理解: 競合他社特許や先行特許を詳細に分析し、自由に開発可能な領域を見定めることが重要です。イーライリリー社のエキセナチド、デュラグルチド、チルゼパチド開発や、ノボノルディスク社の脂肪酸修飾アプローチ開発はこの好例です。
- オープンイノベーションの活用: イーライリリー社のエキセナチド開発や、ノボノルディスク社のリラグルチド開発のように、戦略的な協業や外部技術の導入を積極的に検討することが有効です。
- 柔軟な開発戦略: イーライリリー社が、エキセンディン-4由来、Fc融合体及びGLP-1/GIP二重作動といった複数のアプローチを採ったように、市場動向や競合状況に応じて開発の方向性を柔軟に調整することが重要です。
- 市場ニーズの的確な把握: ノボノルディスク社が肥満治療市場を開拓したように、現状の臨床ニーズだけでなく、潜在的なニーズを見据えた開発計画の策定が重要です。
- 長期的視点: ノボノルディスク社の肥満治療薬開発や、イーライリリー社のチルゼパチド開発のように、他社特許満了後の戦略や市場変化を見据えた長期的な開発計画が必要です。
これらのポイントは、メガファーマ特有の問題ではなく、リソースの限られたベンチャー企業にこそ有意義です。効果的な開発を行うためには、特許戦略と開発を密接に連携させ、市場のニーズと技術的可能性のバランスを取りながら、長期的な視点で戦略を立てることが重要です。
今後も、各社の特許戦略と創薬の動向、特に既存薬の特許満了に向けた戦略や新たな適応症の開発、さらなる改良型GLP-1RAの開発など、研究開発と特許戦略の両面から注目していく必要があります。
バイオ医薬に関する特許調査とセミナー情報
当サイトを運営している日本アイアールは特許調査・技術調査をコア業務としており、バイオ医薬関連技術についても専門性の高いサーチャーチームが対応しています。ニーズに応じて最適な調査プランをご提案しますので、お気軽にお問い合わせ下さい。
[※関連サイト:バイオ分野の特許調査・文献調査サービスについてはこちら]
また当サイトにおいて、バイオ医薬分野に関連する技術セミナー、法律・知財・薬事に関するセミナーも多数ご紹介しております。ご興味がある方は是非チェックしてください。
 《この記事の執筆者》
《この記事の執筆者》
木羽 邦敏(弁理士)
ランフォード国際特許事務所 代表
日本アイアール株式会社 バイオ調査コンサルタント
本記事に記載された特許情報および満了(予定)日などの情報は、一般的な情報提供を目的とし、限定的な調査に基づいて作成されたものです。この情報は、完全性や正確性を保証するものではありません。本記事の情報に基づいて行われた判断や行動によって生じたいかなる損害についても責任を負いません。
バイオ技術の特許に関する調査及び判断を行う際は、使用される技術や権利内容の理解が難しいケースも多く、完全性や正確性を確保するためには、高度な知見を持つ特許事務所や特許調査会社などに相談されることをお勧めします。
《引用文献、参考文献》
- 1) Mojsov S, et al : J Biol Chem, 261(25) : 11880-9. 1986
- 2) Mojsov S, et al: J Clin Invest, 79(2): 616-619. 1987
- 3) US6849708.
https://patents.google.com/patent/US6849708B1/en?oq=US6849708 - 4) US5118666.
https://patents.google.com/patent/US5118666A/en?oq=US5118666 - 5) US5614492.
https://patents.google.com/patent/US5614492A/en?oq=US5614492 - 6) JP2583257.
https://patents.google.com/patent/US5614492A/en?oq=US5614492 - 7) Yao H, et al: BMJ, 384. 2024
- 8) glp-1 agonists and human diabetes.2015.
https://www.glucagon.com/glp1agonists.html - 9) Yu M, et al: Adv Drug Deliv Rev, 130: 113-130. 2018
- 10) Dr. John Eng’s Research Found That The Saliva Of The Gila Monster Contains A Hormone That Treats Diabetes Better Than Any Other Medicine.2007.
https://www.diabetesincontrol.com/dr-john-engs-research-found-that-the-saliva-of-the-gila-monster-contains-a-hormone-that-treats-diabetes-better-than-any-other-medicine/ - 11) USPTO Patent assignment search for 5424286.
5424286.https://assignment.uspto.gov/patent/index.html#/patent/search/resultFilter?searchInput=5424286 - 12) Knudsen LB: ACS Pharmacol Transl Sci, 2(6): 468-484. 2019
- 13) Knudsen LB, Lau J: Front Endocrinol (Lausanne), 10: 155. 2019
- 14) Mark M: IDrugs, 6(3): 251-258. 2003
- 15) 田牧 千裕:日薬理誌、146:215-224,2015
- 16) 624821A.
https://patents.google.com/patent/US5624821A - 17) US6204007B1.
https://patents.google.com/patent/US6204007B1 - 18) How a Lucky Break Fueled Eli Lilly’s $600 Billion Weight-Loss Empire.2024.https://www.bloomberg.com/news/features/2024-01-26/zepbound-how-eli-lilly-s-lucky-break-fueled-a-600b-weight-loss-empire
- 19) Ozempic Commercial.2018.
https://www.youtube.com/watch?v=YlF5XrTO6rw - 20) Cresswell C. Ozempic and the commercial medicalisation of beauty.2024
https://www.onpoint-nutrition.com/blog/ozempic-wegovy-mounjaro-off-label-for-weight-loss - 21) Aikens A. Sounding the Alarm on Off-Label Use of Ozempic, Wegovy, and Mounjaro for Weight Loss.2023.

















































