3分でわかる 希土類金属(レアアース)の基礎知識・要点解説

目次
1.希土類金属(レアアース)とは?
高付加価値産業を支える希土類金属(レアアース, rare earth element,REE,また稀土とも書く)はその供給懸念が強まって以来、世界から注目されています。
一口にレアアースと言っても、単一の金属や鉱物ではなく、性質の近い21Scスカンジウム、39Yイットリウムと、ランタノイドの15元素の計17元素の総称のことです(図1、表1)。
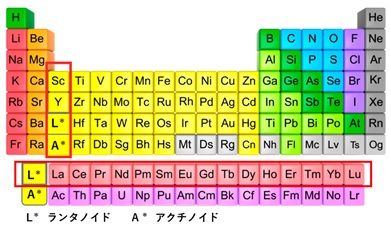
【図1 元素周期表中の希土類金属の位置】
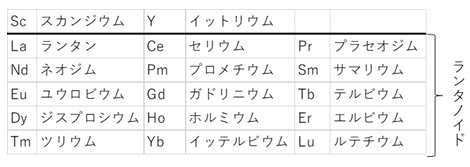
【表1 希土類金属の元素記号と和名】
2.希土類金属の分類
ランタノイドの中で、La-Euを「軽希土類元素」(light rare-earth element、LREE)、Gd-Luを「重希土類元素」(heavy rare-earth element、HREE)と呼びます。
3.希土類金属の電子配置と物理化学性質
(1)電子配置
ランタノイド金属の原子番号は57ー71で、その外殻電子配置はN、O、P電子殻の4f、5d、6sに属します(Sc とYの原子番号は21と39、最外殻電子はそれぞれ3d、4sと4d、5sに配置します)(表2)。
(2)物理化学性質
希土類元素は代表的な金属元素で、金属反応性はアルカリ金属とアルカリ土類金属に次ぐものです。
反応の活性で並べると、Sc、Y、Laの順で増加し、LaからLuまで減少します。つまり、Laが最も活発です。
希土類元素は酸化物、ハロゲン化物、硫化物などの形で安定的に存在することができます。塩酸、硫酸、硝酸に容易に溶けます。
ランタノイド元素の電子は、サブシェルの4f軌道に1個ずつ詰まっていきます。
その軌道は最外殻の5d、6s軌道の内側にあり、化学結合にあまり影響がありません。
最外殻の5d、6s軌道の電子配列があまり変わらないため、ランタノイドの各元素は性質がよく似ています。
ランタノイドのほとんどは安定な3価イオンとなりますが、一部の化合物においては2価や4価でも準安定となる場合があります。特にセリウム(Ce)は4価、ユウロピウム(Eu)は2価も安定に存在しています(表2)。
物理化学性質に影響を与えるのは主に半径になります。
希土類金属と配位子が錯体を形成する際、配位子による6-14など様々な配位数が見られます。
ただし、La3+ からLu3+まで、イオン半径が短くなると、EDTA類配位子の場合、配位数はLa3+の9配位からLu3+の6配位になる傾向があります。
| 原子番号 | 元素記号 | 原子量 | 原子外殻 電子配置 | イオン外殻 電子配置(3+) | 原子価 | 原子半径(Å) | 3+イオン半径(六配位)(Å) | 色(3+イオン) 塩水溶液 |
| 21 | Sc | 44.97 | 3d14s2 | 3d0 | +3 | 1.63 | 0.88 | 無色 |
| 39 | Y | 88.92 | 4d15s2 | 4d0 | +3 | 1.78 | 1.04 | 無色 |
| 57 | La | 138.92 | 5d16S2 | 4f0 | +3 | 1.87 | 1.17 | 無色 |
| 58 | Ce | 140.13 | 4f15d16s2 | 4f1 | +3, +4 | 1.83 | 1.15 | 無色 |
| 59 | Pr | 140.92 | 4f36s2 | 4f2 | +3, +4 | 1.82 | 1.13 | 緑 |
| 60 | Nd | 144.27 | 4f46s2 | 4f3 | +2, +3, +4 | 1.81 | 1.12 | 赤紫 |
| 61 | Pm | 147.00 | 4f56s2 | 4f4 | +3 | 1.80 | 1.11 | 淡赤 |
| 62 | Sm | 150.35 | 4f66s2 | 4f5 | +2, +3 | 1.79 | 1.10 | 淡黄 |
| 63 | Eu | 152.00 | 4f76s2 | 4f6 | +2, +3 | 1.98 | 1.09 | 無色 |
| 64 | Gd | 157.26 | 4f75d16s2 | 4f7 | +3 | 1.79 | 1.08 | 無色 |
| 65 | Tb | 158.93 | 4f96s2 | 4f8 | +3, +4 | 1.76 | 1.06 | 1.06 |
| 66 | Dy | 162.51 | 4f106s2 | 4f9 | +2, +3, +4 | 1.75 | 1.05 | 黄 |
| 67 | Ho | 164.94 | 4f116s2 | 4f10 | +3 | 1.74 | 1.04 | 淡黄 |
| 68 | Er | 167.27 | 4f126s2 | 4f11 | +3 | 1.73 | 1.03 | 桃色 |
| 69 | Tm | 168.94 | 4f136s2 | 4f12 | +2, +3 | 1.72 | 1.02 | 淡緑 |
| 70 | Yb | 173.04 | 4f146s2 | 4f13 | +2, +3 | 1.94 | 1.01 | 無色 |
| 71 | Lu | 174.99 | 4f145d16s2 | 4f14 | +3 | 1.72 | 1.00 | 無色 |
【表2 希土類元素の電子配置、原子価及び半径と色】
4.ランタノイド収縮
元素周期表の半径規則によって、半径は同じ周期では周期表の左から右に減少し、同じ族では上から下に増加します。
ただ、隣接するランタノイド金属原子間の半径の差は、非遷移金属や他の遷移金属と比べて異常です。
LaからLuまで併せて14.3pmを減少します。更にイオン半径は、La3+の117 pmからLu3+の100 pmまで顕著に低下します。
第6周期のランタノイド元素は、第5周期の同族元素の原子半径と近く、更に小さくなる場合もあります。
この現象を「ランタノイド収縮」といいます(表2)。
この効果は、4f電子による核電荷の不十分な遮蔽(電子に対する核の引力)に起因します。
通常、電子が外殻に追加されると、すでに存在する電子が外側の電子を核電荷から遮蔽し、核でより低い実効電荷の引力を受けます。
ランタノイド原子の電子配列は、内部の4fサブシェルに電子が1個ずつ詰まっていきます。
f’エネルギー準位は分散しすぎているため、空間での軌道の広がりは比較的大きく、4fサブシェル電子は原子核への遮蔽は不十分で、外殻(n=5 or 6)電子は原子核に向かって引き寄せられるため、原子(イオン)半径が小さくなります。
内部電子(サブシェル)による遮蔽効果は、 s > p > d > f の順に減少します。
5.希土類金属の重要性
希土類元素は、酸素、硫黄、鉛などと結合しやすく、融点の高い化合物を形成するため、溶鋼に希土類元素を添加することで鋼を純化することができます。希土類元素の金属原子半径は鉄よりも大きいため、結晶粒や欠陥を埋め尽くし、結晶粒子を微細化して、鋼の性能を向上させます。
また、希土類元素は満たされていない4f電子殻構造を持っているため、さまざまな電子エネルギー準位を生成します。したがって、発光材料、磁性体として、蓄電池や発光ダイオードなどのエレクトロニクス製品の性能向上に必要不可欠な材料となっています。
そして、イオン半径や電荷など希土類独特の化学的性質を用いて、触媒、固体電解質、酸化物高温超伝導体、水素吸蔵合金などにも、広く使われています。
6.希土類金属の分離
3価希土類金属イオンは性質がよく似ていますが、固有性質の磁性や光吸収特性はそれぞれ異なります。そのため先端材料として希土類金属を利用する場合は、他の希土類元素から分離して、精製することが必要です。
性質の類似したイオンを分離する目的で開発された方法は、主に沈殿法、イオン交換法、溶媒抽出法があります。
沈殿法は溶解度の違いを利用して、結晶化や沈殿を繰り返して、分離する方法です。
イオン交換法はイオン交換樹脂を用いて、異なる溶離液を流して、樹指との結合力の小さいイオンから順に溶かし出すことができ、分離します。溶離液がこの方法のキーポイントで、キレー卜試薬がその一つです。
溶媒抽出法は液体-液体抽出で、異なる溶解度または分配系の間で、イオンが一つの溶媒から別の溶媒に移動し、溶媒を抽出することで、精製します。水と混ざり合わない有機溶媒に配位子を溶かし、金属イオンを含む水溶液と振り混ぜると、金属イオンが配位子と結合して錯体が形成します。錯体が水より有機溶媒に溶けやすい場合は、金属イオンを有機溶媒相に移し、分離することができます。
他に膜の利用法や沈殿抽出の組み合わせ法などもありますが、ここで割愛します。
7.中国における希土類資源分布状況と主な中国企業
中国は世界最大のレアアース生産国です。
その分布には「北軽南重」の特徴があます。
内モンゴル自治区包頭の軽希土鉱床、四川省涼山の軽希土鉱床、江西省贛州(かんしゅう)をはじめとする南方5省の中重希土鉱床の三大生産拠点があります。内モンゴル包頭のバヤンオボ鉄、ニオビウム、希土類共生鉱床は、希土類埋蔵量が世界最大であり、軽希土類が希土類鉱物の79%を占めます。江西省贛州市は重希土類の製錬分離の中心地で、五鉱稀土と贛州稀土集団の本社がそこにあります。
近年、産業統制を強化するため、中国ではレアアース産業の南北二極のパターンを形成しつつあります。
(1)中国北方希土(集団)
中国北方希土(集団)(China North Rare Earth (Group))は、1961 年に設立され、前身は包頭鉄鋼希土類実験工場(Baotou Steel Rare Earth Experimental Plant)です。内モンゴル自治区包頭市希土類ハイテク産業開発区に位置し、白雲オボ希土類資源と希土類研究所の科学資源の利点を併せ持ちして、主に軽希土類精鉱及び機能材料の生産と販売を行っています。
会社の製錬分離生産能力は120,000トン/年、希土類金属生産能力は10,000トン/年、希土類機能材料の磁性材料合金は41,000トン/年、研磨材生産能力は23,500トン/年、水素貯蔵合金は8,300トン/年、発光材料は100トン/年、希土類触媒は 12,000立方メートル/年を占めているとされています。
(2)中国稀土集団
中国国有の希土類金属企業「中国稀土集団」は、2021年12月23日に設立されました。
国有資産監督管理委員会の下で運営され、五鉱稀土、中国稀有稀土股份有限公司、贛州稀土集団有限公司が傘下に入ります。
ということで今回は、希土類金属について知っておきたい基礎知識をご紹介しました。
次回は、希土類金属の磁性体への応用について解説します。
(日本アイアール株式会社 特許調査部 H・L)
《引用文献、参考文献》
- 塩川二朗,「希土類元素の物性とその応用」, 電気化学および工業物理化学 58 巻 (1990) 8 号
https://www.jstage.jst.go.jp/article/kogyobutsurikagaku/58/8/58_702/_pdf/-char/ja - N.E.Topp著,塩川二朗,足立吟也訳,希土類元素の化学,化学同人(1974)
- 加納剛,柳田博明,レア・アース,技報堂(1980)
- レア・アース(増補改訂版),新金属協会(1980)
- 塩川二朗監修,レア・アースの最新応用技術,シーエムシー(1985)
- 太田 充恒,「希土類元素って?」 産総研(Webサイト)
https://staff.aist.go.jp/a.ohta/japanese/study/REE_ex_bs.htm - 足立吟也,希土類の科学,化学同人(1999)
- 鈴木 康雄,希土類の話,裳華房(1998)
- 馬淵 久夫,元素の辞典,朝倉書店(1994)
- 太田 充恒,「マンガン団塊の希土類元素」,月刊海洋 号外25「現代海洋化学・II」(2001)
- 百度百科,企業概要ページ(中国のWEBサイト)
中国北方稀土(集团)高科技股份有限公司
中国稀土集团有限公司