3分でわかる技術の超キホン 遷移金属の基礎知識

今回のコラムでは、遷移金属について解説します。
1.遷移金属とは
遷移金属(transition metal)は、周期表で第3族から第11族元素(第3族~第12族と定義されることもあります)の間に存在する元素からなる金属単体です(図1)。
典型金属元素は、内殻から外殻の順で電子が入っていき、閉殻構造となります。
一方、遷移金属は、内殻のd軌道またはf軌道に空の軌道を持ったまま、外殻のs、d軌道に電子が入っていくので、典型元素の金属とは異なる化学的性質を有しています。
第12族元素(亜鉛族元素、Zn、Cd、Hg)はイオン化してもd軌道が10電子で満たされて閉殻しており、化学的性質が典型元素の金属に似ており、IUPACの定義より典型元素に分類されますが、遷移元素に分類される例も見られます(図1、表1)。
また、dブロック元素とfブロック元素との分け方もあります。
ランタノイドおよびアクチノイドを「fブロック元素」と、他の3-12族の金属を「dブロック元素」と呼びます。第12族亜鉛族元素はdブロック元素に含まれています(図1)。
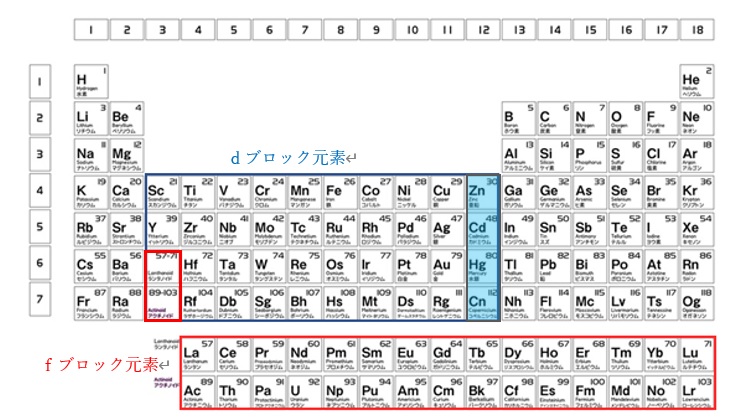
【図1 遷移元素、dブロック元素及びfブロック元素の関係図】
2.遷移元素の特徴
遷移元素は豊富なd電子(f電子)を有しています。
典型金属元素では、s軌道とp軌道電子は、主量子数の小さい軌道が大きい軌道を超えて外側に分布することは殆どありません。
一方、遷移金属元素のd軌道あるいはf軌道電子の分布は広く、主量子数が大きいs軌道、p軌道の内側にも外側にも分布する性質があります。
d軌道やf軌道に空きがあったままで、s軌道やd軌道に先に電子が充填していく方が、系全体的にエネルギーが低く安定しています(図2、表1、表2)。
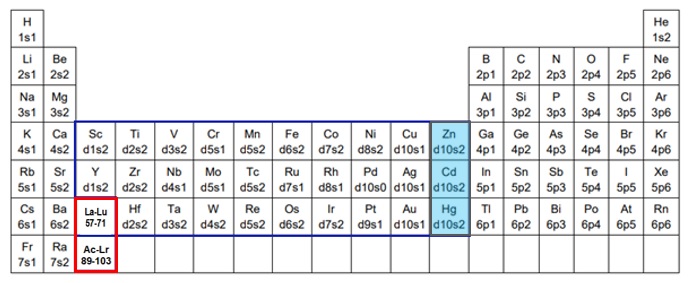
【図2 遷移元素の外殻電子配置】
【表1 dブロック遷移金属の基本データ】
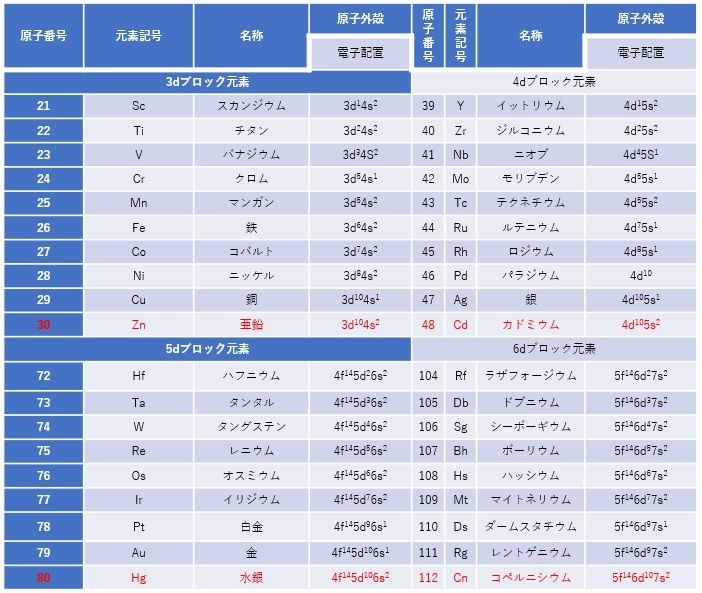
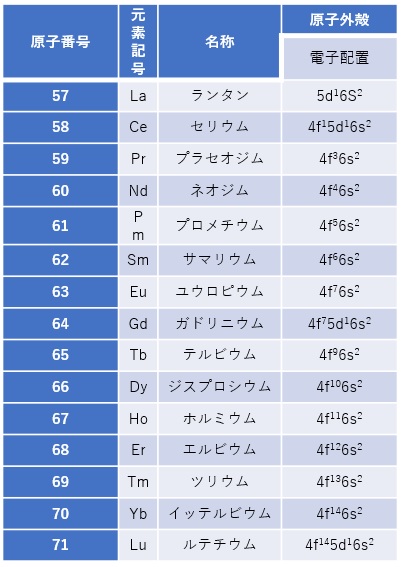
【表2 fブロック遷移金属の基本データ】
遷移金属の原子半径は、元素周期表の半径規則にほぼ従います。同じ周期では周期表の左から右に減少し、同じ族では上から下に増加します。
ただし、例外もあります。その原因はランタノイド元素の「ランタノイド収縮」に由来します。
核遮蔽による準位への影響で、隣接するランタノイド(アクチノイド)金属原子間の半径の差は、非遷移金属や他の遷移金属と比べて異常に小さいです。ランタノイド以降の元素のサイズにも大きな影響を与えます。第6周期の遷移元素は、第5周期の同族元素の原子半径と近く、更に小さくなる場合もあります。
例えば、第4族元素(Ti、Zr、Hf)を見てください。第5周期のZrは第4周期のTiより原子半径もイオン半径も通常通り増加しているものの、第6周期のHfはZrより両半径ともにやや減少となります。これはHfの直前にランタノイドが位置して、ランタノイド収縮による効果に由来するからです。
[※関連コラム:希土類金属(レアアース)の基礎知識・要点解説 もご参照ください。]
典型元素は同じ族の元素が似ている性質を有するのに対して、遷移元素では周期が違うと同族元素であっても性質が異なるケースがしばしば見られます。
また、d軌道やf軌道の外部にも広く分布する電子が多数存在するということは、金属結合に関与できる電子が多く、多数の電子が結合力を増大させるということも意味します。
豊富なd電子(f電子)が存在しているため、遷移元素の単体は一般的に高い融点と硬さを有する金属で、常磁性を示すものが多いです。化合物や水和イオンが色を呈するものも多くあります。
さらに、様々な配位子と錯体を形成できるほか、触媒として有用なものも多く、注目を集めています。
次回は、遷移金属の電子配置と性質についてご紹介します。
(日本アイアール株式会社 特許調査部 H・L)