3分でわかる 自己組織化って何ができる?主な用途を解説 (DDS/人工酵素/分子デバイス)

自己組織化の相互作用について解説した別記事「超分子とは何か?基本原理と自己組織化の代表例をやさしく解説」では、水素結合、π-πスタッキング、疎水性相互作用などの分子間の弱い相互作用は自己組織化の駆動力となることを説明しました。
自己組織化によって形成された構造体は、しばしば特殊な機能を発現するため、自己組織化は様々な分野で利用されています。
今回は、自己組織化が利用されている、DDS、人工酵素、分子デバイスの3分野についてご紹介します。
1.超分子ドラッグデリバリーシステム(DDS)
ドラッグデリバリーシステム(Drug Delivery System, DDS)を訳すと「薬物輸送(送達)システム」です。
異なる薬物投与方法により体内での分布をコントロールして、量的、空間的、時間的に制御する薬物を輸送します。
DDSの主な種類・役割
① 標的化
標的薬物送達システム(TDDS)は、薬剤が標的細胞と選択的に結合し、薬剤粒子が目標組織に高濃度で集積することによって、薬の量と副作用を減らし、治療効果を向上させることができます。
例えば、リポソームや高分子ミセルに薬剤を包摂して、がん組織に蓄積させることにより、効果の向上を実現できます。

[図1.標的薬物送達システムの概念図]
② 放出制御
短時間で吸収・分解されてしまう薬物を、長時間にわたって一定の速度で放出し、体内への供給を持続させるよう工夫された製剤があります。
経口摂取すると、時間制御の方法によって薬物が胃腸管の特定部分で放出されるように、外殻は崩壊剤で構成されます。
パルスリリース時間はシェルの厚さと透水性を調整することで制御できます。
③ 吸収改善
吸収されにくい薬物を、内包によって多く吸収させるデリバリーシステムです。
④ ナノドラッグデリバリーシステム
ナノテクノロジーは、薬物送達に新しい方法と手段を提供します。
例えば、パッケージング、埋め込み型薬物送達方法、造影剤、マイクロニードルなどがあります。
技術的な側面では、樹脂、ナノチューブ、フラーレン、ナノ粒子が含まれます。
現在、遺伝子治療や核酸医薬の登場で注目が高まっています。
2.超分子人工酵素
生体内の化学反応で触媒として機能しているのは酵素です。
酵素は、主に、分子認識、選択性、触媒機能を持ち合わせるという極めて高機能な分子です。
選択性がはるかに高く、生体環境という温和な条件下でその機能を発揮することができます。
分子間の弱い相互作用を駆動力とする自己組織化は、選択性と分子認識を示し、触媒機能のあるゲスト分子の内包による、超分子人工酵素の構築も可能となります。
また、触媒機能的な金属イオンの配位を利用し、分子カプセルを構築し、反応基質を内包すれば、人工酵素の実現が期待できます。
このように、人工的にデザインして構築できるπ-πスタッキングシステムは、期待度の高い有望な技術であり、さらに、ゲストの金属錯体の内包と放出も自在にコントロール可能です。
超分子人工酵素に関する技術の進展は、今後も注目を集めていくものと思われます。
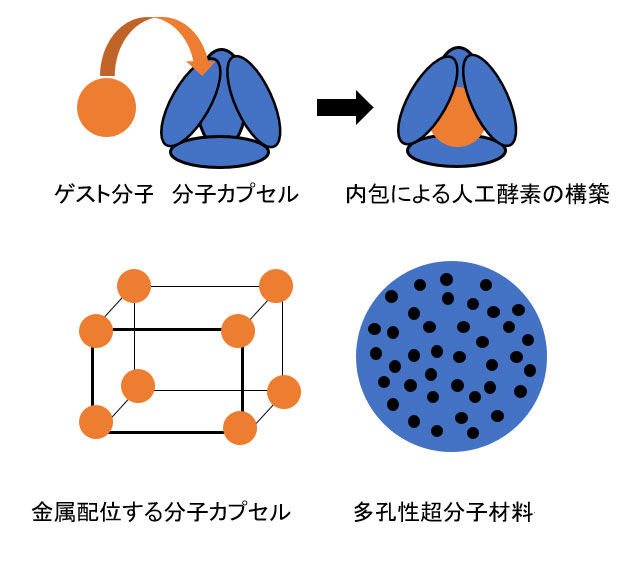
[図2.人工酵素のモデル構築例]
3.分子デバイス
電子デバイス等の微細化が進む中では、”top-down”(*1) のアプローチよりも、”bottom-up”(*2) の手法で組み立てていくアプローチの方が望ましいとも言われています。
例えば、小型のスイッチ、ワイヤー、コンデンサーなどの部品を組み合わせることよりも、分子設計の段階において、各機能の分子が自己組織化によって超分子デバイスを構成するほうがはるかに理想的です。
現在主流となっている電子デバイスの多くは、無機材料を中心に構成されていますが、分子設計や合成・作製などの面において有機分子はとても有利です。
また、π平面性配位子のスタッキング型積層構造では、軌道間の重なりが大きいために、HOMO-LUMOのギャップが十分に下がれば高い導電性を示す可能性が高いことが分かっています。これによって、さまざまな特性や機能を持つ有機エレクトロニクス分子が創り出されています。例えば分子ワイヤー、分子スイッチ、分子ジャンクション等が挙げられます。
設計したパターンに配置し、相互に連結することで「分子回路」を構成することが可能となります。
(*1)top downアプローチ:大きな素材を削っていくことにより、微細構造を得る方法
(*2)bottom upアプローチ:分子単位を組み立てて、微細デバイスを作ること
ということで今回は、超分子の自己組織化を利用した技術として、DDS、人工酵素、分子デバイスの3つを簡単にご紹介しました。今後もその技術動向には要注目です。
(日本アイアール株式会社 特許調査部 H・L)