3分でわかる 二次電池の仕組みと種類・特徴 (ニッケル水素電池/鉛蓄電池/リチウムイオン電池)

世の中の多くの携帯機器は、電池で動作しています。
今回は、特に充電可能な二次電池を中心に説明していきます。
目次
1.二次電池とは?
「二次電池」とは、繰り返し充放電ができる電池を指します。「蓄電池」ともいいます。
二次電池は、一次電池と同じで化学電池です。
したがって、電解液と活物質が常に接触しているため自己放電が起こり、しかも一次電池以上に自己放電率が高いという特徴があります。
そのためフル充電しても、長期間放置した場合には使用する前に充電する必要があります。
二次電池の放電・充電(基本原理)
図1と図2は、一般的な二次電池の放電と充電の様子を示した図です。
《二次電池の放電の仕組み》
まず、図1は、放電の様子を示しています。
電池内では正負の二つある電極の内、負極では酸素と結合することなどによる酸化反応によって電子が放出されます。逆に、正極では電子を吸収することによって還元反応が起こります。
つまり、負極で発生した余剰電子が、正極で起こる還元反応によって不足する電子を補うように移動しているのです。
それぞれの極で発生する酸化還元反応は、電極の材質や電解液によって異なりますが、これらは化学反応を起こすことができなくなるまで(反応に必要な物質がなくなるまで)化学反応を起こし、完全放電するまで電気を発生させ続けることができます。
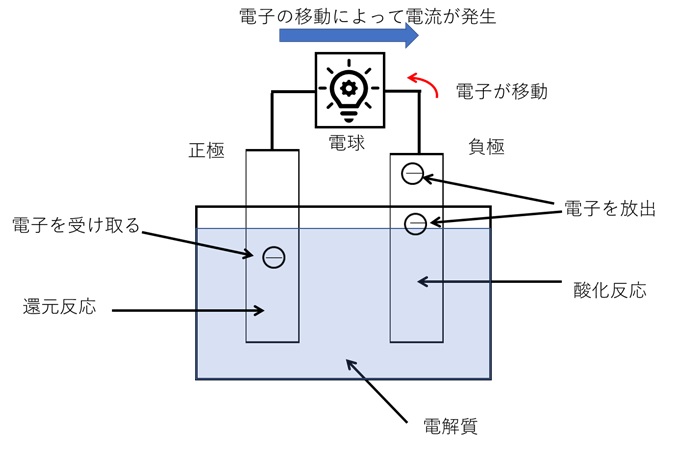
【図1 二次電池の放電(イメージ図)】
《二次電池の充電の仕組み》
次に、図2は充電の様子を示しています。電気を電池に送り込んで再使用できるようにするのが「充電」です。
完全放電してしまった電池内では、すでに電気化学反応が起こらない状態で、電池内の物質が化学平衡状態を保っています。
しかし、正極から電気を抽出し負極に電子を与えるような化学反応を起こすことにより、放電前の状態に戻すことができます。放電時とは逆に正極で酸化反応が起こり、負極で還元反応が行われるのです。
二次電池内では、放電時とは逆に外部電源から送り込まれた電子によって、放電時とは逆の電気化学反応が起こっているのです。
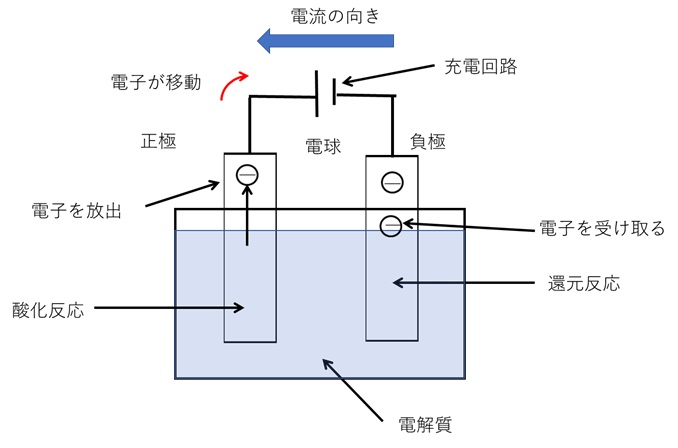
【図2 二次電池の充電(イメージ図)】
2.主な二次電池の種類と特徴
(1)ニッケル水素電池
図3は、二次電池のうち、乾電池の代わりに使える充電池として使われている「ニッケル水素電池」の簡単な構造を示した図です。
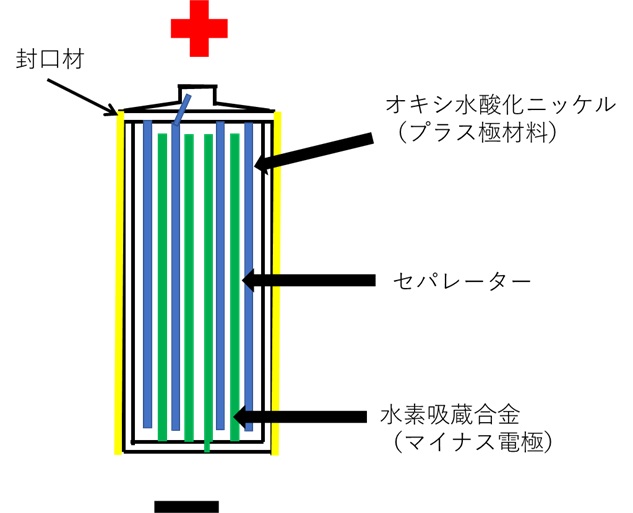
【図3 ニッケル水素電池の構造】
図3において、ニッケル水素電池は、負極活物質が水素吸蔵合金、正極活物質がオキシ水酸化ニッケル、電解質が水酸化カリウム溶液となります。
構造は、電解質を含んだセパレータを挟んで、正極板と負極板をロール状に巻いたものを円筒形の筒に入れたものになります。
負極活物質の「水素吸蔵合金」とは、もともと金属には、水素を吸収する性質があるものが多く、それらを合金化したもののことを言います。水素吸蔵合金は、チタン系や希土類系、マグネシウム系など多くの種類が開発されており、ニッケル水素電池の負極材としては、ニッケルとランタン(希土類)の合金などが使われています。
[※関連記事:水素吸蔵合金の特徴と課題は?低コスト化の可能性を秘めた新規な水素吸蔵合金とは ]
ニッケル水素電池の特徴(長所・短所)として、下記の点が挙げられます。
① ニッケル水素電池の長所(メリット)
- エネルギー密度が高い(マンガン乾電池やアルカリマンガン乾電池と同等以上。ただし、リチウムイオン電池よりは低い)
- サイクル寿命(*1)は500~1500回ほどと容量維持率が高い
- リチウムイオン電池と比べ、発火の危険性が少なく安全性が高い
② ニッケル水素電池の短所(デメリット)
- メモリー効果(*2)が若干ある
- 公称電圧(1.2V)が乾電池(1.5V)よりも低い
- 自己放電が比較的大きい(月数%~30%程度、電池、温度等によります)
(*1)サイクル寿命とは?
「サイクル寿命」とは、電池の寿命を表し、放電から充電までを1サイクルとして、電池が劣化して使用できなくなるまで何回サイクルを繰り返すことができるかを表したものです。
(*2)メモリー効果とは?
「メモリー効果」とは、二次電池の容量を残したままで放電を止めて、継ぎ足し充電することを繰り返すと、使用可能な容量が残っているにもかかわらず、電圧が急に低下してしまう現象のことです。容量を最後まで使い切ることで解決できます。
(2)鉛蓄電池
もっとも古くから使用されていて、自動車のバッテリーに多く利用されています。
鉛蓄電池は、正極活物質が二酸化鉛、負極活物質が鉛で、電解液は硫酸を使っています。
放電すると、プラス極側では、二酸化鉛が硫酸鉛に変化し、マイナス極側では、鉛(金属)が硫酸鉛に変化します。また、充電すると、逆の化学反応が起こって、プラス極側は二酸化鉛に戻り、マイナス極側は鉛(金属)に戻ります。硫酸鉛から分離した硫酸イオンは電解液に戻ります。
鉛蓄電池の長所は、電圧が2Vで、材料が鉛で安価であることです。
短所としては、放電時に生成した硫酸鉛が固い結晶となる「サルフェーション」を起こしやすい点があります。
(3)リチウムイオン電池
現在使用されている二次電池で最も一般的なものが、リチウムイオン電池です。
リチウムイオン電池は、正極活物質にリチウムを含む酸化物、負極活物質に黒鉛、電解質に有機電解液を使っている電池のことです。
リチウムイオン電池は、充放電の際に、リチウムがイオン(Li⁺)の形になって有機電解質の中に溶け出し、プラス極とマイナス極の間を往復します。
特徴は、電圧が3.6V程度と高くエネルギー密度が高い点と、メモリー効果がない点です。
リチウムイオン電池は、現在も、材料や構造の研究が進められており、さらなる高性能化が期待できます。
[※リチウムイオン電池に関する詳しい解説は「リチウムイオン電池を学ぶ」の記事をご参照ください。]
以上、今回は二次電池の概要について簡単に解説しました。
二次電池には、他にも多くの種類の電池があるので、使用状況に合わせて最適な電池を選ぶことが必要です。
(日本アイアール株式会社 特許調査部 E・N)














































