【ナノ粒子分散 理論編】相互作用の種類、凝集のメカニズムと分散技術の基本《ナノ粒子入門②》

ナノ粒子を材料として使用する際、多くの場合、様々な水、有機溶媒、ポリマーなどの媒体に分散させる必要があります。しかしながら、ナノ粒子は強く凝集するという特徴があり、簡単に均一に媒体へ分散させることは難しいのが現状です。
今回のコラムは、ナノ粒子分散‐理論編として、ナノ粒子はなぜ凝集してしまうのか?分散させるにはどのようなアプローチがあるのか?について、理論的な部分を解説します。
目次
1.凝集とは?分散とは?
まずは、「凝集」「分散」についての定義とイメージを確認しましょう。
凝集とは、一次粒子が付着し、粒子の塊(二次粒子)になることを言います。
分散とは、塊を一次粒子近くになるまでほぐれていること(ほぐすこと)を言います。(図1)
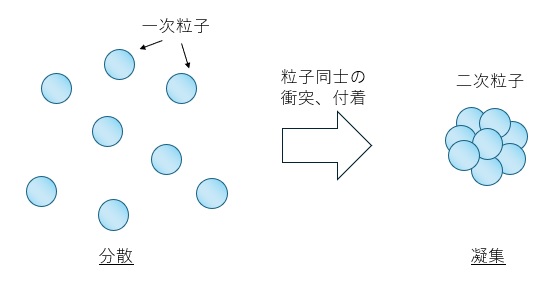
【図1 分散、凝集のイメージ】
- 一次粒子:
粉体やエアロゾル中などでの粒子の最小単位。化学反応などで生成した最初の状態の粒子で,それを構成する分子間の結合が連続で界面を有する。その後の過程で,凝集などにより二次粒子やさらに高次の状態になることがある。1) - 凝集:
粒子同士が衝突し付着する現象のことを凝集といい,気相および液相中の高濃度微粒子分散系の動力学的挙動を支配する重要な因子であり,凝集により全粒子の総体積は保たれるが,粒子数が減少し,粒子の大きさが増大する。1)
一般的に分散、凝集は、大きな粒子ほど分散しやすく、粒子が小さくなるほど凝集が強くなる傾向があります。ただし、粒子の組成、分散媒によっても状態は変化します。
では、凝集はなぜ起こるのか、そのメカニズムを詳しく見ていきましょう。
2.凝集はなぜ起こる?
(1)粒子間に働く力とは?《相互作用力の種類》
まずは、液中で粒子間に働く相互作用にはどのようなものがあるかを見ていきます。(表1)
分散、凝集に関与する相互作用力はいくつかあり、そのバランスにより分散するか、凝集するか決まります。
【表1 粒子間に働く主な力】
| 相互作用力 | 機構 | 作用 |
| London van der Waals力 (ロンドン・ファンデルワールス力) |
原子や分子の電気的な偏りに起因する引力。弱い力ではあるが、粒子が小さくなるという影響が大きくなる。 |
凝集 |
| 界面静電相互作用 | 粒子の表面電荷の対イオンが粒子表面に集まり形成される拡散電気二重層の影響で働く斥力。 |
分散 |
| 立体障害効果 | 粒子表面に吸着した分子が別の粒子との衝突を阻害する効果。 |
分散 |
| 架橋形成作用 | 高分子、溶媒などが粒子間に架橋を作ることで発生する引力。 |
凝集 |
また、日本語では粒子同士が付着し塊となることを一律に「凝集」と呼びますが、その構造は凝集機構により変化し、付着の強さも異なってきます。粒子同士が化学的な結合で付着もしくは融着して凝集する「Aggregation」や、London van der Waals力や静電的な作用で起こる「Agglomeration」、高分子などの凝集剤で形成する密度の低い「Flocculation」などがあります。
付着の強さは Aggregation>Agglomeration>Flocculation となり分散性にも影響します。(図2)
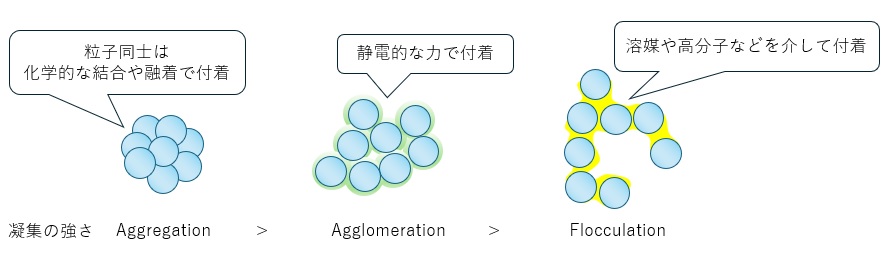
【図2 凝集構造と強さ】
(2)水中での分散‐DLVO理論による理解
特に水などの極性溶媒中粒子の分散・凝集挙動は、表1で確認したvan der Waals力と静電相互作用が影響し、DLVO理論で説明ができます。
粒子は、水などの極性溶媒中で表面電荷とは反対符号の対イオンが粒子表面に集まって拡散電気二重層を形成しています。そのため、他の粒子が接近すると静電相互作用により斥力が働きますが、更に接近するとvan der Waals力による引力が働き凝集します。
図3には粒子間ポテンシャルと粒子間距離との関係を模式的に示しました。
横軸の粒子間距離が小さくなるほど、縦軸の斥力ポテンシャルが大きくなりますが、ある距離を超えて小さくなると今度は斥力ポテンシャルが急激に小さくなり、凝集することが示唆されます。
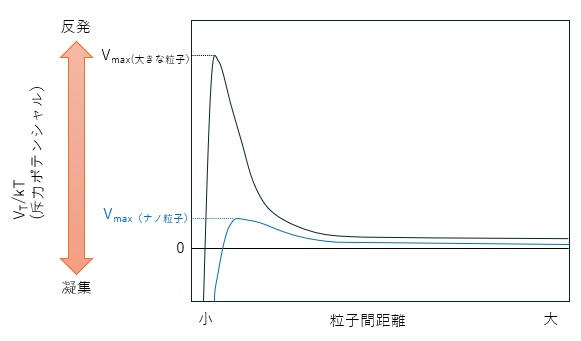
【図3 DLVO理論による粒子間ポテンシャルの模式図】
ここで重要なのが、斥力ポテンシャルの最大値(Vmax)は、粒子径に依存するということです。
図4、5に大きな粒子とナノ粒子の静電作用のイメージをまとめました。
いずれの粒子でも粒子同士が接近した際には、粒子間の対イオン濃度が上がります。
大きな粒子では、対イオン濃度を下げようと溶媒が浸透し斥力となります。一方で、ナノ粒子では対イオンの大きさが粒子の大きさに近づき、対イオンは粒子間から簡単に拡散できるため斥力が弱くなります。
このことがナノ粒子のように小さな粒子になるほど容易に凝集を起こす原因となるのです。
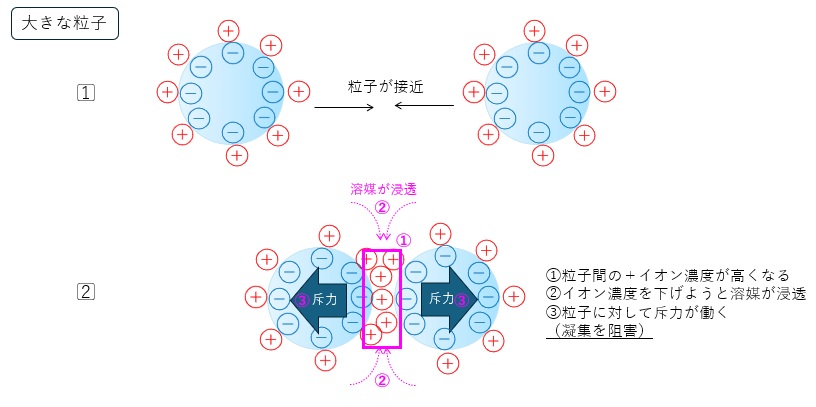
【図4 粒子接近時の対イオンの挙動イメージ(大きな粒子)】
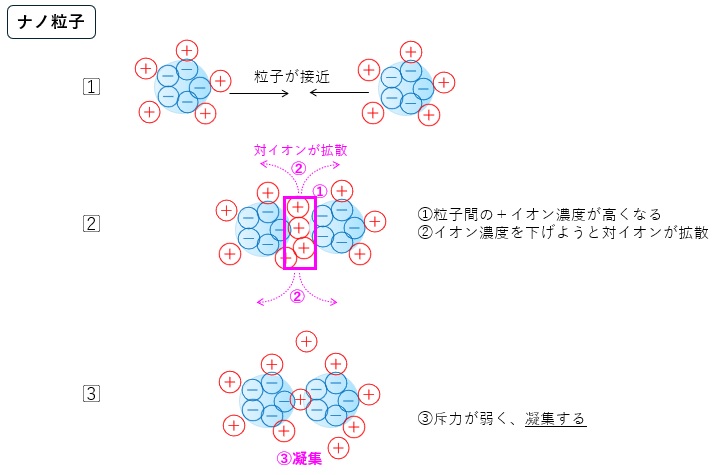
【図5 粒子接近時の対イオンの挙動イメージ(ナノ粒子)】
3.分散へのアプローチ
それでは、最後にナノ粒子を分散させるためのアプローチについて見ていきたいと思います。
上述のDLVO理論に基づく水などの極性溶媒中での分散アプローチとしては「表面電荷の絶対値を上げること」が挙げられます。表面電荷を高くすることで、図3におけるVmaxが大きくなり、凝集を抑制することができます。表面電荷は粒子の組成や表面状態で変化しますが、ゼータ電位を測定することにより評価できます。
表面電荷はpHによって変化し、表面電荷が0となるpH(等電点)では凝集が起こりますが、等電点よりも酸性、もしくはアルカリ性へ調整することで分散しやすくなります。
有機溶媒中での分散(シランカップリング剤による例)
また、DLVO理論は水系溶媒中での理論であるため、有機溶媒や高分子中に分散化させるためには別のアプローチが必要です。有機溶媒中での分散は「立体障害効果」(表1)を利用することが一般的です。粒子表面に有機分子を導入し、溶媒への親和性や粒子表面の直接接触を阻害します。
例えば、図6にナノ粒子にシランカップリング剤を用いる例を示します。
(※シランカップリング剤の基礎知識は「3分でわかる シランカップリング剤とは?」をご参照ください)
シランカップリング剤はナノ粒子表面に結合し、粒子表面に有機鎖を導入します。この有機鎖の影響により、粒子同士の衝突を防ぎ凝集を阻害します。
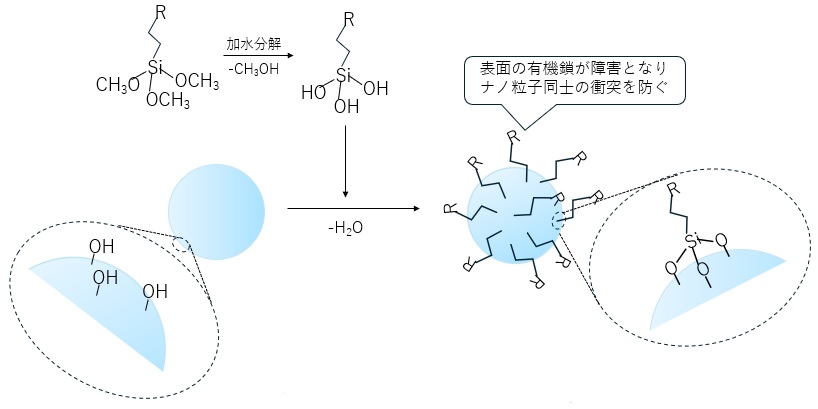
【図6 シランカップリング剤によるナノ粒子表面処理のイメージ】
今回は、ナノ粒子の分散について理論的な観点で解説を行いました。
次回は「ナノ粒子の分散 実践編」として、実際に分散化を行う際にはどのような方法があるのか、主な装置(分散機)などについて解説します。
(日本アイアール株式会社 特許調査部 M・S)
《引用文献、参考文献》
- 1) 粉体工学会編「粉体工学用語辞典 第2版」(日刊工業新聞社,2000)
- 2) 神谷秀博「ナノ粒子の凝集・分散と表面処理技術」, 成形加工, Vol.18, No.9, pp.620-625(2006)
- 3) 神谷秀博「表面構造設計によるナノ粒子の凝集・分散制御」, オレオサイエンス, Vol.16, No.2, pp.57-63(2016)
- 4) 神谷秀博,飯島志行「ナノ粒子の分散挙動制御とその応用」, 粉砕, No.55, pp.12-18(2012)
- 第1回: ナノ粒子とは?特徴、作り方、用途、危険性など要点解説!
- 第2回: 【ナノ粒子分散 理論編】相互作用の種類、凝集のメカニズムと分散技術の基本
- 第3回: 【ナノ粒子分散 実践編】分散液の作製方法、ビーズミルなど分散機の概要を解説
- 第4回: 粒度分布測定方法の種類と注意点