リチウムイオン電池の電解液② スルホンアミド系、イオン液体、水系

今回は、近年大きな進歩があった、スルホンアミド(スルホニルイミド)系電解質、イオン液体を使用した電解液、および水系電解液について説明します。
目次
1.スルホンアミド系電解質と高濃度電解液
2000年頃から、リチウムスルホンアミド(スルホニルアミド、スルホニルイミドなどとも呼ばれます)、特にフッ素原子を含むスルホンアミドはリチウムイオン二次電池の電解質として検討されてきました。
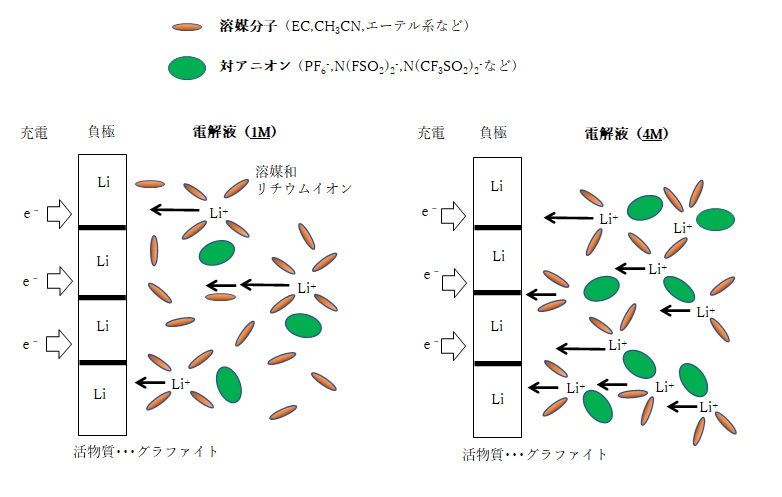
リチウムビス(ペンタフルオロエタンスルホニル)アミドLi(CF3CF2SO2)2N(LiBETA,LiBETI)、リチウムビス(トリフルオロメタンスルホニル)アミドLi(CF3SO2)2N(LiTFSA,LiTFSI)、リチウムビス(フルオロスルホニル)アミドLi(FSO2)2N(LiFSA,LiFSI)などです。
スルホンアミド系電解質とLiPF6を比較すると、大まかには、電気導電率はほぼ同程度(7-10mS/cm;LiTFSA<LiPF6<LiFSA;1M エチレンカーボネートEC/ジメチルカーボネートDMC=1/1(v))であり、耐酸化性はほぼ同程度です。大きな相違点は、耐加水分解性(LiPF6<<LiFSA,LiTFSA)および熱安定性が向上(LiPF6<<LiFSA<LiTFSA)することです。
しかし、カーボン系負極活物質とコバルト酸リチウムなど遷移金属酸化物系正極活物質からなる、一般的な~4V級リチウムイオン電池(エチレンカーボネートEC/ジメチルカーボネートなど鎖状カーボネート=1/1、電解質濃度1M)に使用した場合、~10回程度しか充放電サイクルを回せませんでした。スルホンアミド系電解質では、正極集電体であるアルミニウムの腐食(酸化、溶解)が進行するためです。
その原因は、LiPF6とは異なり、不完全な不働態被膜しか形成されない(特にLiTFSA,LiFSA)という点にあります。LiPF6では、微量の水分により発生するフッ化水素に由来するフッ化アルミニウムなどが不働態被膜を形成し、アルミニウムの腐食を抑制します。
電解質濃度を上げることで電池性能がアップ?
ところが、電解質濃度を高濃度(2~5M)にすると、LiPF6を使用した場合より充放電サイクル特性やレート特性が改善することが判明しました。
電解質濃度が1M以下の場合より電池特性が良好であること、LiPF6では必須であったECが無添加でも(ニトリル系溶媒やエーテル系溶媒単独でも)安定して電池を作動できます。LiPF6/EC系とは全く相違しています。
スルホン系アミド電解液で問題となっていたアルミニウム正極集電体の腐食も抑制されます。
負極活物質上に形成されるSEIは、高濃度のFSAアニオンに由来(還元分解物など)する物質で構成され、LiPF6-EC系における溶媒由来のものとは異なるもので、SEI層の厚さも薄いものでした。
電解質の「高濃度効果」をもたらす理由とは?
上記の高濃度効果とも呼べる結果は、実験および計算によるシミュレーションから、以下のように説明されています。
低濃度電解液(通常使用される1Mなど)では、Liカチオンは溶媒分子のみが配位した状態で存在します(溶媒和)。また、溶媒和していないフリーの溶媒分子が多数存在します。
充電を開始すると電圧が低下し、溶媒和Liカチオンが負極(活物質・・・グラファイト)に向かって移動します。Liカチオンは、溶媒和したままグラファイト層間に挿入(共挿入)されます。Liカチオンが還元されてグラファイト層間に挿入されるとともに、溶媒分子も還元分解されて各種二次生成物を与えます。
多数存在するフリーの溶媒分子に溶解しない生成物を与える場合、負極化物質と電解液との界面に堆積します(SEI)。充放電を繰返しても消失し難いSEIは、Liカチオン伝導性かつ電子絶縁性の不働態被膜として機能します。また、SEIは溶媒の共挿入も抑制します。
SEIの形成は溶媒に依存し、ECでは比較的良好な不働態被膜を与えますが、プロピレンカーボネート(PC)、ニトリル系、スルホキシド系、スルホン系など多くの溶媒は使えません。
充放電に伴い、EC系低濃度電解液で生成するSEIは増減を繰返しながら(充電時に増加、放電時にハフリーの溶媒に溶解・拡散して減少)、少しづつ厚みを増していき、電池容量や作動電圧の低下につながります。
高濃度になると、Li対アニオンがいろいろな形で配位したクラスター(溶媒、対イオンなどが配位した状態)が出現し、フリーの溶媒分子は減少する一方、未配位のアニオンはほとんど存在しない状態になります(下図を参照)。
リチウムイオンクラスターは、溶媒やLi対アニオンの種類、濃度、温度などにより変化します。
溶媒やLi対アニオンの種類は、Liカチオンに対する配位力の差異として現れます。(PF6-<TFSA-、FSA-;CH3CN<EC)
充電時、負極活物質上では、溶媒分子の還元分解より、配位した対アニオンの還元分解が優先してきます。
対アニオンに由来するSEIが主体(スルホンアミド系電解質では、LiF、LiCF3、LiSO2CF3など)となり、溶媒分子との接触を抑制します。
溶媒の還元分解により形成されるSEIとは異なり、充放電サイクルを繰り返しても、SEI層の厚さの増大を抑制することができます。
これは、ほとんどフリーの溶媒が存在しないため、形成されたSEIの溶解があまり起きず、活物質と溶媒との接触(共挿入)を継続して抑制するためと考えられます。
スルホンアミド系電解質を高濃度に含む電解液が、これまで一般的に使用されてきたLiPF6/EC系電解液(1M)より、充放電サイクル特性やレート特性が良好なのはこの理由によります。
SEIの形成に対する溶媒の関与がほとんどないため、ECを含まなくとも安定して電池を作動できることになります。アセトニトリルやエーテル系などこれまで使用できなかった溶媒も使えることになり、電池設計の自由度が増します。
イオン伝導度は電解質濃度の増大に伴い増大しますが、一定濃度(約1M)以上になると、電解液の粘度上昇の影響が大きくなりイオン伝導度は減少します。
粘度の上昇は電解液により異なり、LiPF6/EC系よりLiFSA/アセトニトリルのほうが小さいことが判明しています。また、電解液の粘度はDMCなど共溶媒の添加により調整できます。
これらの効果が影響しあって、電池特性として現れることになります。
LiFSAを中心に、より優れた電解液を模索
なお、LiTFSAとLiFSAを比較すると、電池特性はLiFSA電解質のほうが優れています。
FSAアニオンがTFSAアニオンより、Liに対する配位力が少し弱いこと、およびLiFSAではSEIにLiFなどフッ化物ドナーが多く含まれていることが関係しているとされています。
LiFSAを中心に、溶媒、複数の電解質の組合せ、添加物などの検討が進み、新たな電解液の提案が活発です。
※左から順に下記を示します。
- LiBETA リチウム ビス(ペンタフルオロエタンスルホニル)アミド
- LiTFSA リチウム ビス(トリフルオロメタンスルホニル)アミド
- LiFSA リチウム ビス(フルオロメタンスルホニル)アミド
2.イオン液体を使用した電解液で、不燃化・難燃化!
これまで説明してきたリチウムイオン二次電池の電解質は、媒質として有機溶媒を使用しています。
程度の差はありますが、可燃性です。また、毒性もゼロではありません。
何らかの原因で電池の温度が上昇すると、火災や爆発を起こすリスクがあります。
電解液の不燃化あるいは難燃化へのアプローチのひとつがイオン液体の使用です。
イオン液体とは、イオン(アニオン、カチオン)のみからなり、常温常圧で液体の化合物です。
水や酸素に対して安定な化合物も多数見つかっています。
一般的なイオン性結晶(塩)とは異なり融点が低く(融点が常温以下なので、常温溶融塩とも呼ばれる)、幅広い温度域で液状を保つ、蒸気圧がほとんどない、難燃性である温度域が広い、有機溶媒と比較して電気導電性が高いなどの特徴を持っており、以前から電解質の非水媒体として研究されてきました。
(※イオン液体の基礎知識は「3分でわかる イオン液体とは何か?]をご参照下さい)
特定のイオン液体を使用すると、溶媒や添加剤を加えずに、十分な充放電サイクル特性を有するリチウムイオン二次電池(カーボン負極活物質)となることが判明しました。
その代表例が、下記のFSAアニオンとイミダゾリウムカチオン(1-エチル-3-メチルイミダゾリウム)からなるイオン液体(EMImFSA;25℃粘度17 mPa・s、25℃電気伝導率16.5 mS/cm)です。
LiTFSA(LiFSA)/EMImFSA電解液では、通常使用される1M LiPF6/(EC+DEC)電解液と同等の充放電サイクル特性と、それを超えるハイレート放電特性が確認されています。
一方、TFSAアニオンとイミダゾリウムカチオンからなるイオン液体(EMImTFSA;25℃粘度45.9mPa・s、25℃電気伝導率8.4mS/cm)では粘度が高すぎてサイクルを回せません。
- EMImFSA 1-エチル-3-メチルイミダゾリウム ビス(フルオロスルホニル)イミド
3.水系電解液でも不燃化へ
電解液の不燃化に対する他のアプローチは水媒質を使用することです。
しかし、水の電位窓が狭いので、一般的な~4V級のリチウムイオン二次電池では分解され使えませんでした。
近年、水、リチウムスルホンアミド、および異なる複数のリチウム塩を特定の割合で混合すると、共晶により融点が下がり、常温で液体の常温溶融水和物(ハイドレートメルト)となることが発見されました。一種のイオン液体です。
例えば、LiTFSA0.7mol/LiBETA0.3mol/水2molの組成からなるハイドレートメルトです。
実験および計算によるシミュレーションから、ハイドレートメルトでは全ての水分子がLiカチオンに配位している(フリーの水分子が存在しない)ことが判明しています。
上記のハイドレートメルトを電解質として使用した2.4V級、および3.1 V級リチウムイオン二次電池では安定した作動が確認されています。
(日本アイアール株式会社 特許調査部 Y・W)










































