3分でわかる技術の超キホン 物質の色と光の関係を早わかり解説

物質自体に色は付いていない?
世の中に様々な色を持つ物質があります。その色は光と何の関係があるのでしょうか?
実は物質自体は色が付いているわけではなく、色が付いて見えるのは太陽や照明から出る白色光が物に当たると、一部が物質に吸収されて、その透過光(吸収された色の補色)を見ることによって物質の色が付いて見えます。
例えば、物質が緑色の光を吸収すると、赤く見えます。(図1)

【図1.補色のイメージ図】
物質が一定波長の光だけを吸収する理由は?
普通、物質はそれぞれ固有の色を示すので、一定波長の光だけを吸収することを意味しています。
では、なぜでしょうか?
ご存じのように、物質は分子か原子に構成されます。
原子核の外側にマイナスの電子が飛び回っています。
その電子たちは一定のルールに沿って、それぞれに決まったエネルギー準位の原子軌道あるいは分子軌道に配置され、物質の色はその物質が持つ”電子配置状態”によって決まります。
物質は光を吸収する前の電子状態は「基底状態」と、吸収した後は「励起状態」と呼びます。
光吸収の前と直後では、分子の構造は保持したままで、ただ、分子軌道間で電子の遷移が起こるだけです(Frank-Condon状態)。
ご存じのように、光は電磁波の一種で、式1で波長とエネルギーの関係を示します。
E=hc/λ ・・・式(1)
ここで、cは光の速度、hはプランク定数、λは波長。波長が短いほど電磁波の持つエネルギーが大きいです。
光が吸収されることにより、電子は基底状態にある軌道から、エネルギーのより高い空軌道へとジャンプします。(図2)
この時のエネルギー差は同じように ΔE=hc/λ で表します。
そして、ΔEと等しいエネルギー準位に励起状態が存在しないと、その光は吸収されないことも意味しています。吸収スペクトル測定の実験により、物質がどのエネルギーの光を、どの程度を吸収するかが分かります。
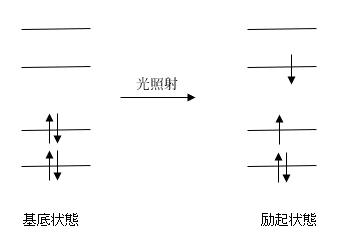
【図2.基底状態と励起状態の電子配置】
つまり、上述の通り物質の電子配置状態が決まっており、光を当てると、励起する必要なエネルギーΔE(一定の波長)を持つ光だけを吸収して、電子遷移が起こり、透過光は補色として見えるということです。
電子軌道・電子遷移の特徴と「色」の関係
上記の説明は最もシンプルな例を挙げていますが、実際、一つの物質でも色々なエネルギーの光を吸収することが多いです。
物質を構成する分子には、σ軌道上の電子は強く束縛されて、π軌道上の電子は弱く束縛されます。
そして、分子構造によって、電子の束縛状態も違いますので、吸収する光のエネルギーはさまざまなレベルがあります。
また、光吸収すると電子遷移は起こりますが、遷移に関与する電子軌道の種類もさらに細かく分類されます。
例えばσ-σ*遷移、π-π*遷移、n-π*遷移があり、更に金属を導入すると、d-π*遷移、d-d遷移なども挙げられます。
特に遷移金属錯体では、d軌道と配位子の軌道との間の相互作用によって、新たにCT遷移という強い電荷移動遷移が現れて、電子豊富な配位子から金属原子の軌道へ電荷移動するLMCT遷移(Ligand to Metal Charge Transfer)と逆のMLCT遷移(Metal to Ligand Charge Transfer)があります。これらの特徴から物質特有の色を呈することになります。(図3)
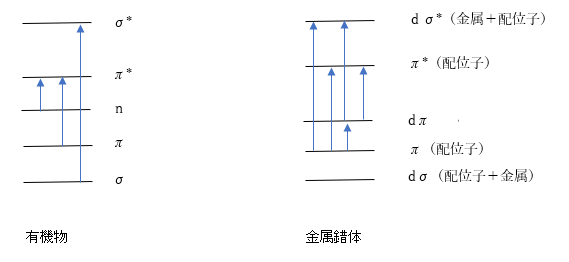
【図3.有機物と金属錯体の典型的な光吸収と電子遷移】
例えばd軌道に0電子で酸化数が違うCrO42-(クロム酸イオンCr6+)とMnO4-(過マンガン酸イオンMn7+)はそれぞれ濃い黄色と濃い紫色を呈します。
酸化数が高くなるにつれ、空のd軌道のエネルギー準位が低くなり、電子を受け入れやすい傾向となって、酸素配位子の非共有電子対の軌道とのエネルギー差が小さくなります。
その結果、LMCT吸収は長波長側に、その補色は短波長側にシフトして(黄色→紫色)、呈色します。また、赤色を示す[Fe(phen)3]2+と赤橙色を示す[Ru(bpy)3]2+はMLCTに由来する吸収が観測されます。
これらの錯体は金属のt2g(dπ)軌道から、ヘテロ芳香族配位子の共役系のπ*軌道へ、電子遷移が起こります。
(日本アイアール株式会社 特許調査部 L・H)