核酸医薬の種類と特徴がわかる!修飾・DDSなど注目の改良技術も解説

核酸医薬品は化学合成されるオリゴヌクレオチド(DNA、RNA、それらの誘導体)及びそのコンジュゲートが有効成分となる医薬品です。
低分子医薬品や抗体医薬品に続く第3の医薬品として核酸医薬品が期待されています。
今回は、化学合成で作られる「オリゴ核酸医薬品」について解説します。
目次
1.オリゴ核酸医薬品の種類
タンパク質をコードしない十~数十塩基が連結したオリゴヌクレオチドを基本骨格としたオリゴ核酸医薬品は、mRNAやmiRNAなどの核酸を標的とするもの(①~④)と抗体医薬品のようにタンパク質を標的とするもの(⑤~⑦)とが知られています。
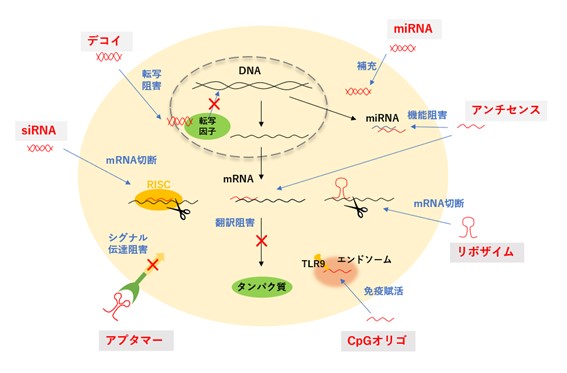
[図1:核酸医薬品の作用機序]
① アンチセンス
一本鎖DNAもしくはRNAで、細胞内で相補的な配列の標的RNAに結合し、タンパク質への翻訳を阻害します。
標的mRNAにDNA 型核酸を結合させRNaseHによってmRNA分解する”Gapmer型”、mRNA前駆体にRNA型核酸を結合させスプライシング因子の接近を阻害しエクソンをスキップさせる”スプライシング制御型”、miRNAと標的mRNA の結合を阻害する”miRNA阻害型”があります。
核酸医薬品としてアンチセンスは最初に承認され、2021年時点では最も多く承認さているカテゴリーです。
最近ではジストロフィン遺伝子変異があるデュシェンヌ型筋ジストロフィーに対するアンチセンス核酸医薬品が承認されました。これはエクソン45・スキップ治療薬として、アンチセンスオリゴによりジストロフィン遺伝子のmRNA前駆体の変異部分をスキップさせ、アミノ酸読み取り枠のずれを修正し、ジストロフィンタンパク質の産生を増加させる治療法になります
② siRNA(small interfering RNA)
二本鎖RNAもしくはヘアピン型一本鎖RNAで、細胞内の標的RNAを特異的に切断し、遺伝子発現を阻害します。
siRNAはRNA干渉の原理を用いており、細胞内でRNA誘導型サイレンシング複合体(RNA-induced silencing complex:RISC)と複合体を形成し,相補的なmRNAに結合し切断します。
siRNA はアンチセンスオリゴと比較して、安定性および細胞透過性が低いため、細胞内に到達させるために脂質ナノ粒子などのキャリアを利用したドラッグデリバリーシステム(DDS) が必要となります。
siRNA核酸薬としてはOnpattro(patisiran)が遺伝性ATTR アミロイドーシスの治療薬として日本では初めて承認されています。
③ miRNA(micro RNA)
二本鎖RNAもしくはヘアピン型一本鎖RNA、その類似体で、疾患などで低下している内在性のmiRNAを補充する目的で用いられます。
内在性のmiRNAは標的遺伝子の非翻訳領域に結合することで遺伝子発現を調節しています。特にがん領域では、発がんにより低下しているmiRNAが多く同定されており、標的遺伝子に対する制御バランスを補うためのmiRNA補充療法の研究開発が進んでいます。siRNAと同様にDDSが必要となります。
④ リボザイム
酵素機能を持つ一本鎖RNAで、標的RNAに結合して切断します。
ハンマーヘッド型は標的RNAと相補的な配列のアンチセンス領域とループ領域で構成されており、標的RNAと結合するアンチセンス領域をDNAと置き換えたDNA-RNAキメラ型リボザイムも研究されています。
リボザイムは化学合成したものと、遺伝子組換えによるリボザイム発現ベクターの研究が行われています。
⑤ デコイ
二本鎖DNAで、転写因子が結合するプロモーター領域と同じ配列を持ち、細胞内で転写因子と結合して、転写因子により制御される遺伝子の発現を阻害します。
NFκB デコイオリゴは、転写因子NFκB が制御している免疫や炎症反応を制御するサイトカインや接着分子の転写発現を抑制することにより作用し、腰痛症治療薬として臨床試験が実施されています。
⑥ アプタマー
一本鎖DNAもしくはRNAからなり塩基配列に依存した立体構造によりタンパク質に結合し機能阻害をします。
受容体に結合することでシグナル伝達阻害や、細胞外タンパク質に結合することで機能を阻害します。抗体医薬品と比較するとタンパク質への結合性や特異性が高く、化学合成できるメリットがあります。
またポリエチレングリコールを付加することにより体内での滞在時間が改善され、PEGを付加した核酸医薬品のアプタマーでは滲出型加齢⻩斑変性症の治療薬として血管内皮成長因子VEGF165を標的としたMacugen(pegaptanib)が日本でも承認されています。
⑦ CpGオリゴデオキシヌクレオチド
一本鎖DNAでCpGモチーフ(シトシンとグアニンがホスホジエステル結合でつながった配列)を持ち、エンドサイトーシスで取り込まれ、エンドソーム膜に発現するToll様受容体9(TLR9)に作用し自然免疫を活性化します。
他の核酸医薬品とは異なり、ワクチンの核酸アジュバンドとして用いられ、承認されているB型肝炎ワクチンのHEPLISAV-BはB 型肝炎ウイルス表⾯抗原とアジュバントとしてCpG オリゴが用いられています。
2.オリゴ核酸医薬品の改良技術
オリゴ核酸医薬品はタンパク質だけでなくRNAを標的とし、標的特異性高く、化学合成で製造できるため生産が容易である点が大きなメリットになります。
一方、分解を受けやすいため生体内での安定性が低く、副作用、細胞透過性などにおける問題点もあるため、以下のような方法で改良が進んでいます。
① 核酸修飾技術
体内でのヌクレアーゼによる分解を避けるために、リン酸部、糖部、塩基部のいずれかが修飾されています。
リン酸部の修飾はリン酸ジエステル結合の非架橋酸素原子を硫黄原子に置換したS化(図2,a)によりヌクレアーゼの耐性および細胞内への取り込みが改善します。
糖部では2’部位の修飾として2 ‘-F(図2,b)、2 ‘-O-Methyl(2 ‘-OMe)(図2,c)、2 ‘-O-Methoxyethyl(2 ‘-MOE)(図2,d)がすでに承認された核酸医薬品に用いられており、架橋型修飾としてLocked Nucleic Acid(LNA)[2 ‘,4 ‘―BNA](図2,e)などが開発されています。
また、核酸の糖部をモルフォリノ環に置換したモノフォリノ核酸(図2,f)はヌクレアーゼによる分解を受けず、生体内での安定性が向上し、毒性が低くなっています。
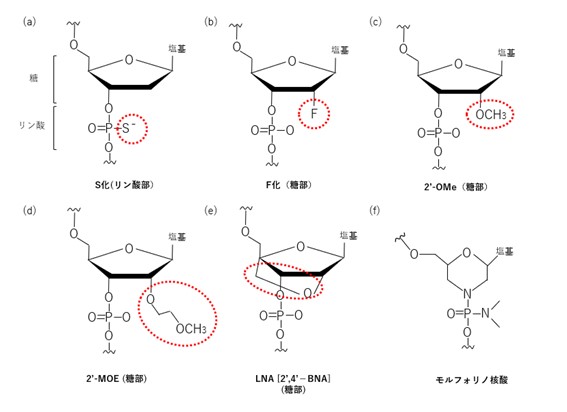
[図2:核酸修飾方法]
② ドラッグデリバリーシステム(DDS)の改善
オリゴ核酸の細胞内への取り込みはエンドサイトーシスによりオリゴ核酸がエンドソームを介して細胞質に移行すると考えられ、細胞内への取り込みの改善技術としてDDS技術が開発されています。
送達キャリアとしてsiRNAを脂質で封入したナノ粒子や高分子ミセル、核酸送達のためにsiRNAと結合させたコンジュゲートが開発されています。
siRNA を脂質で封入したナノ粒子であるLNP (lipid nanoparticle)は血中でApoE(アポプロテインE)と結合し、ApoE 受容体を発現する肝実質細胞内に取り込まれて標的遺伝子に作用します。
GalNac コンジュゲートは、肝実質細胞に特異的に高発現するアシアロ糖タンパク質受容体のリガンドである GalNAc(N-アセチルガラクトサミン)とsiRNAを結合したもので、送達のためのキャリアを必要としないため、品質管理が容易で今後さらなる技術開発が期待されています。
以上、今回はオリゴ核酸医薬について解説しました。
核酸医薬品はこれまで治療が困難であった遺伝子疾患やがん、感染症など幅広い領域で注目され、核酸医薬品の市場はさらに拡大することが見込まれます。
(日本アイアール株式会社 特許調査部 N・Y)