3分でわかる技術の超キホン 「ナノDDS」は何が凄いのか? [ERP効果,キャリアの種類等]

目次
1. いま注目のナノDDSとは?
以前の当連載コラムで、DDS(ドラッグデリバリーシステム)の基礎知識をご紹介しました。
現在この分野で注目を集めている技術の一つが、ナノテクノロジーを活用した「ナノDDS」(ナノサイズのキャリアに分子を搭載した粒子)です。
実用化されている例としては、リン脂質などをカプセル状にした微粒子に薬剤を内包した「リポソーム製剤」があります(図1)。
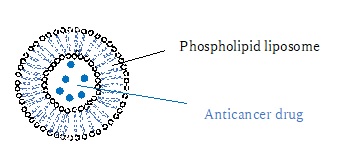
【図1 ナノリポソームのイメージ】
ナノテクノロジーはナノメーター(10-9m、 10億分の1メートル)スケールの物質を扱うテクノロジーです。
1nmはほぼDNAのサイズで、10μm(マイクロメートル、 10-6m)スケールの細胞よりはるかに小さいです(図2)。
また、フラーレンやカーボンナノチューブ等のナノ材料の発見により、ナノDDS向けの様々な研究が盛んに行われています。
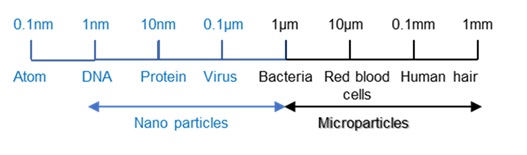
【図2 ナノおよびマイクロ粒子の範囲】
実際、現在ドラッグとして利用されるDDS微粒子のサイズは、150nm程度のものが中心になっています。
その原因の一つは、このサイズの微粒子が体内に滞在しやすいからです。微粒子のサイズが数nm以下と小さい場合、一般にヒト腎臓から尿中に容易に排泄されてしまうため、体内に滞留することが難しくなります。
一方、微粒子のサイズが400nm以上と大き過ぎると、免疫機構が働き、異物排除により体内から素早く排除されてしまいます。
なお、がん腫瘍の診断治療の場合では、腫瘍の血管の漏出性(EPR、 Enhanced Permeation and Retention)効果を利用して、このサイズの微粒子を腫瘍に集積させるがんの治療用薬剤があります。
2.EPR (Enhanced Permeation and Retention)効果とは?
がん腫瘍周囲の新生血管は不完全であり、血管内皮細胞の間に隙間が存在しています。そのため、正常の血管は透過しない100-200 nmの高分子薬剤が、腫瘍では血管壁を抜けて組織中へと透過します。
また、腫瘍ではリンパ組織も成熟していないため、組織中の異物を排除することができず、血中から漏れだした高分子薬剤は腫瘍組織中に滞在できるようになります。
このような高分子薬剤が腫瘍へ集積する特性を「EPR(enhanced permeability and retention)効果」といいます(Figure 3)。
つまり、抗癌剤をナノ粒子に封入できれば、正常な血管壁からは漏れ出すことなくがん組織に入り、病変部位だけに薬剤が集まって濃度が上昇することになります。
このように抗癌剤をナノテクノロジーによりナノ粒子にすることでDDS製剤として機能し、医薬品を必要な場所に、必要な時間、必要な量だけ送達することができます。
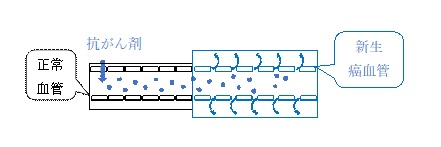
【図3 EPR効果】
3.ナノDDSに使われる主なキャリアの種類
(1)リポソーム
以前の当連載「リポソームとは?」の回で、リポソームについてご紹介しました。
リポソームはリン脂質二重膜から構成される脂質ナノカプセルです(図1)。
生体適合性と安全面で優れていることから、最も研究されてきた薬物ナノキャリアです。
リポソーム内には、様々な薬物を封入することができ、小分子薬物化合物をはじめ、たんぱく質、ワクチン抗原、ウイルス、気体などが挙げられます。近年相次いで登場している核酸医薬でも、リポソームキャリアは重要な貢献をしています。
図1に示したような単純な組成のリポソームは静脈内投与した場合、細網内皮系に捕捉されてしまうことから、血中安定性や滞留性に乏しく、実用化への大きな問題となります。
その解決法としては、リポソームの表面にポリエチレングリコール(PEG)修飾を導入する方法があります。PEG chainの立体障害によって、捕捉作用の阻害となります。また、標的に対するリガンドを結合させれば、ターゲティング能が付与されます。
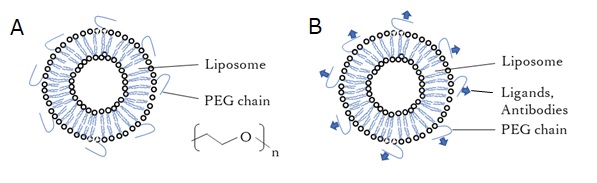
【図4 A) liposome with PEG chain B)ligand-spiked liposome】
(2)ミセル
界面活性剤のように親水基と疎水基をもつ化合物を水に分散させると、親水基を外に疎水基を内に向けて、数十から百数十分子が集まり、球状の会合体を作ります。このような会合体を「ミセル」と呼びます。ミセルのサイズは、数nmから数十nmまで様々です。
ミセルはリポソームと似ており、両方とも両親媒性分子で構成されていますが、リポソームの2つの同心円に配置されたリン脂質の二重層からなる構造に対して、ミセルは両親媒性分子が水中に分散することにより形成された球形の構造です。
ミセルの疎水性内部に疎水性の薬物を内封できますので、ミセルをナノDDSのキャリアとしての研究開発が以前より行われてきました。
研究の一例としては、水に溶けやすい「ポリエチレングリコール(PEG)」と、水に溶けにくいポリアミノ酸からなる「ミセル化ナノ粒子」が挙げられます。30~100ナノメートルの微粒子が疾患部位に集中しやすく、薬物の放出をコントロールすることで薬効と安全性を高めるとされています。
また、リポソームと同様に、ミセルの表面にがんを標的としたリガンドを結合すると、アクティブターゲティング型の粒子となります。
(3)デンドリマー
デンドリマーは樹状のポリマー高分子です。対称性が高く、分岐させていくにつれて、複雑かつ分子量の大きな粒子を作ることができる分子です。
例として、市販されているMPAデンドロンが挙げられます(図5)。
【図5 デンドリマーのイメージ】
デンドリマーの周囲に数多くの官能基を有するため、薬剤の輸送に適しています。
薬剤を送達するために、デンドリマーナノ粒子の表面にPEG鎖もしくは抗がん剤を結合させたものが開発されてきました。
例として以下の三つが挙げられます。
- ① デンドリマー表面に薬剤を化学結合させてプロドラッグとして使う方法
- ② 薬剤をイオン相互作用つまり静電力で付ける方法
- ③ 薬剤を内包させたデンドリマー同士の結合によってミセル化した超分子として使う方法
他には無機化合物のナノ粒子もあります。
多くの無機金属化合物は、がん腫瘍の治療およびイメージングの効果を有しますので、それらのナノ粒子はDDSの素材としてこれまでに多くの研究がされてきました。
例えば、酸化鉄のナノ粒子はその一例です。
カルボキシデキストランで被覆された酸化鉄ナノ粒子が肝臓がんの MRI 造影剤として市販されています。
また、金ナノ粒子は小さめのナノ粒子(5nm~20nm)を作ることができ、それらのサイズ調節が容易にできます。
さらに粒子表面に化学修飾をしやすいので、イメージング応用などの理由から、新しいタイプのドラッグナノキャリアとして期待されています。
薬物輸送用のDDS粒子において粒子のサイズの制御はとても重要です。
近年の研究では、臓器や細胞は、極めて正確にナノ粒子の大きさや形状を識別していることが明らかになっています。
そのため、標的とする細胞が好む形や大きさに厳密に制御、設計したDDS粒子の創成は、効率的な薬物送達のために極めて重要となります。
(日本アイアール株式会社 特許調査部 H・L)







](https://engineer-education.com/wp/wp-content/uploads/2021/08/Experimental-design_0-150x150.jpg)


































