リチウムイオン電池の電解液① LiPF6/EC系

本連載の別コラム「電池の性能指標とリチウムイオン電池」で説明したように、電池として機能するためには、充放電に伴い、正極と負極の間で、電荷キャリアとなるリチウムイオンが移動でき、かつ電子は移動できないことが必要です。
今回は、正極と負極の間にある電解質、リチウム塩(リチウムイオン含有結晶)と有機溶媒からなる電解液、特に広く実用化されている六フッ化リン酸リチウム(LiPF6)/エチレンカーボネート(EC)系の電解液について説明します。
目次
1.電解質、電解液とは?
電池における電解質は、正極と負極の間にあって、電荷キャリアとなるイオンを含む物質です。
リチウムイオン二次電池では、少なくとも一部がリチウムイオンとして存在し、両極間を可逆的に移動する物質です。
電解質としてリチウムイオンを含むイオン性結晶が思い浮かびますが、結晶単独では移動できません。電解質がイオン性結晶の場合、少なくとも一部が媒質に溶解または分散してリチウムイオンとする媒質(溶媒など)が必要です。媒質の選択も重要なので、媒質も含めて電解質、あるいは電解液と呼ぶこともあります。
リチウムイオン含有結晶(リチウム塩)と媒質からなる溶液・分散系の電解液が、多くのリチウムイオン二次電池で使用されています。
結晶相と液相の間に、どちらにも属さない中間相が安定に存在する物質があります。中間相のひとつであるイオン性液体や柔粘性結晶は、電解質として機能します。柔粘性結晶は固体電解質となります。
他の電池材料と同様、電解質やその媒質には、電気化学的安定性(充電時の耐酸化性、放電時の耐還元性)、熱的安定性、化学的安定性が求められます。
また、良質なSEIを形成できる電解液であることが必要です(後述)。
さらに、良好な電池性能を得るためには、両極間を多数のリチウムイオンを高速で移動できること(高電気伝導率)が必要です。
実用化されているリチウムイオン二次電池の多くは、正極活物質として遷移金属酸リチウム(平均電極電位~4V vs Li+/Li)、負極活物質としてグラファイトなどカーボン系材料(平均電極電位0.1~0.2V vs Li+/Li)が使用されています。
その電解液として、1M六フッ化リン酸リチウム(LiPF6)/エチレンカーボネート(EC)含有溶媒が使用されています。
では、この電解液が採用された理由を考えてみましょう。
2.電気化学的安定性と電位窓
電極活物質と接触する電池材料(電解液など)の電位窓上限値(酸化電位)が平均正極電位を下回る場合、充電時に、この電池材料の酸化が進む状態になります。
同様に、電位窓下限値(還元電位)が平均負極電位を上回る場合、還元が進む状態になります。ある物質の電位窓とは、その物質が電気分解されない電位領域を指します。
水の電位窓は3.04~4.07V(vs Li+/Li)で、リチウムイオン二次電池の電解液媒質として使用できないひとつの理由です。
有機溶媒では電位窓が拡がりますが、0.1~4.2Vの範囲を超えるものはありません。
例えば、エーテル系溶媒では耐還元性はありますが、耐酸化性が不足しています。
ニトリル類・スルホン類は耐酸化性には優れていますが、耐還元性に乏しいという具合です。
カーボネート系溶媒は比較的広い電位窓を持つ溶媒のひとつです。
エチレンカーボネート(EC)で1~4.4 V(vs Li+/Li)、プロピレンカーボネートでは少し高電位にシフトします。
《カーボネート系溶媒》
(左から)エチレンカーボネート(EC) プロピレンカーボネート(PC)

(左から)ジメチルカーボネート(DMC) ジエチルカーボネート(DEC)

LiPF6が優れている点のひとつは、耐酸化性が良好なことです。
その酸化電位は約6.3V(vs Li+/Li;PC)で、5V代の四フッ化ホウ酸リチウム(LiBF4)、過塩素酸リチウム(LiClO4)より安定です。
3.SEI(Solid Electrolyte Interface)
カーボン系活物質からなる負極は、充電時には、接触する有機物を還元する能力を持っています。
なぜ、電解液としてLiPF6/EC系を使用した場合、二次電池として安定に作動できるのでしょうか?
また、耐還元性に優れるエーテル系溶媒やEC以外のカーボネート系溶媒を単独で使用した場合、二次電池は安定して作動しません。なぜでしょうか?
充電時、電解液中の溶媒和したリチウムイオンが負極との界面から侵入します。電解液により程度の差はありますが、界面で脱溶媒和したリチウムイオンがカーボン系負極活物質のグラフェン層間に侵入すると活物質粒子は膨張します。
充電時には同時に、強い還元電位に曝されると(1V以下)、侵入した溶媒和イオンの有機溶媒の還元分解が発生します。還元分解生成物は対アニオンとの反応などにより様々な二次生成物を与えます。ECを含む溶媒系で生成する還元分解由来生成物は、活物質と溶媒和イオンとの界面に被膜を生成します。
この電極活物質との界面に生成し、電極活物質を不活性化、安定化(剥離の抑制など)する非電子伝導性の被膜(厚さは数十nm)を「SEI」(Solid Electrolyte Interface)と呼びます。(下図参照)
SEIは溶媒分子の通過を阻害し、溶媒和イオンをの脱溶媒和を促進すると考えられています。
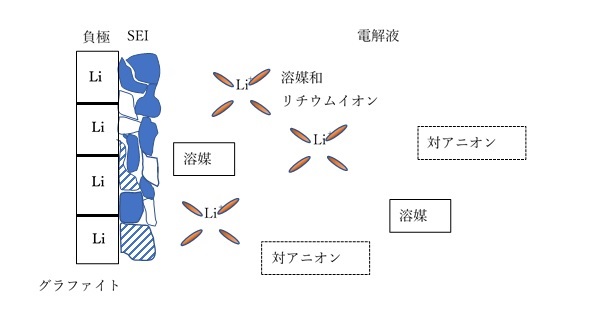
カーボン系負極活物質-LiPF6/EC系電解液では、SEIの成分として(CH2OCO2Li)2、Li2CO3、有機高分子などECに由来する生成物、LiFやLi2OなどLiPF6に由来する生成物が示唆されています。
SEIの生成は、電解液の急激な還元分解による電池の作動不能を防止します。放電時には、リチウムが挿入したグラファイト層からリチウムイオンが脱離して活物質粒子は収縮していきます。充放電に伴う活物質粒子の膨張収縮は、界面のSEI層の亀裂や剥離を誘発します。
負極SEI層の厚さは変化し、充電時に増加し、放電時に減少することが確認されています。
充放電を繰返すことで常にSEI(移動できないリチウム化合物)が生成するため、電池容量が次第に低下します。また、充放電の繰返しでSEI層の厚さが増加していく場合は、内部抵抗も増加し作動電圧が低下します。
SEIが生成しないあるいは不十分な場合には、膨張収縮による活物質粒子の亀裂や集電体からの剥離を誘発し易くなり、急速な電池作動不能につながります。PCなど他の有機溶媒のみではSEIの生成が不十分なのでグラファイト層の剥離が優先し、単独では安定して二次電池を作動できません。
SEIの成分は均一に分布しているわけではなく、活物質との界面に近い部分にはLiF、Li2CO3など無機成分が多く、電解液との界面に近い部分には有機成分が多いことが判明しています。放電時には有機成分が減少すること、安定なSEI層の形成には活物質との界面に近い部分に多い無機成分(特にLiF)の存在が重要であることも判明しています。
LiBF4/EC系でもSEIは生成しますが、充放電を繰返すと、LiPF6より電池性能が劣ります(内部抵抗の増大が大きい)。これは生成するSEIの安定性が劣るということです。安定なSEIを形成する電解液(溶媒、電解質)である必要があります。
4.電気伝導率(導電率、電気伝導度)
電解質Li+A–が液体に溶解している電解液からなるリチウムイオン二次電池を考えます。
放電時、電解液中では、以下のイオン移動が起きています(充電時は逆向きの移動)。
Li+A–(結晶) ⇄ Li+A–(溶解) ⇄ Li+ + A–(解離) (1)
リチウムイオンLi+ ・・・正極に向かって移動
対アニオンA– ・・・負極に向かって移動
電極に向かってイオンが移動すると、対イオンとの再結合や液体分子との衝突などにより抵抗(電気抵抗)が発生します。電解液中のイオンの移動による電気抵抗Rは、以下の式で表されます。
R [Ω] = ρ ・ ℓ / S (2)
(ρ:電気抵抗率、ℓ:イオンの)移動方向の長さ、S:イオンの移動方向に垂直な断面積)
ℓ / Sは電池の形状により決まり容器定数と呼ばれます。
電気伝導率(導電率、電気伝導度)κは、電気抵抗率の逆数として定義されます。電荷キャリアがイオンの場合、イオン伝導率とも呼ばれます。SI単位は[Sm-1](ジーメンス毎メートル)ですが、電解液では[mScm-1]も使われます。
κ[Sm-1]= 1 /ρ (3)
電解液の電気抵抗率および電気伝導率は、イオン濃度およびイオンの移動のし易さ(移動速度)により決まります。LiPF6の電気伝導率が大きいことも長所のひとつです。
上記(1)より推測されるように、イオン濃度は電解質の溶媒への溶解度や解離定数に影響されます。
LiPF6の大きな電気伝導率は、主にイオン解離定数が大きいことに起因しています。
また、解離定数を大きくするため、誘電率が大きな溶媒(EC・・・90,40℃)を選択することも重要です。
電解液中のイオンは、液体分子により溶媒和された状態で存在します。
各イオンの移動のし易さは、この溶媒和されたイオンの大きさ、溶媒の粘度および温度などに影響されます。溶媒の粘度が高いと、イオンの移動速度が低下します。ECは融点が高く(~36℃)粘度も高いので、減粘するために、DMCやDECなど他の溶媒を共用します。
イオン1モルあたりの電気伝導率をモル電気伝導率Λと呼びます。
Λ[Sm2mol-1] = κ / c (4)
(c:モル濃度[molm-3])
電気伝導率は一定のイオン濃度までは増大しますが、それを超えると減少に転じます。
同種イオン同士による反発が無視できなくなるためです。
電気伝導率を最大にする、最適なイオン濃度(電解質濃度)が存在します。
このイオン濃度はLiPF6/EC系では、約1Mです。
5.電解液への添加物
LiPF6/EC(EC-DMCなど)系電解液を使用したリチウムイオン電池でも、充放電サイクル特性やレート特性が不十分でした(サイクルを重ねるごとに、あるいは高レートほど電池容量が低下)。内部抵抗の増大につながるSEI層の厚みの増大に反映されています。
これは負極活物質上のSEI層(電解質および溶媒により決まる)の最適化が不十分であることを意味します。
ビニレンカーボネート(VC)、フルオロエチレンカーボネート(FEC)、1,3-プロパンスルトン(PS)などを微量(0.1~1w%)添加すると、サイクル特性およびレート特性が改善されることが判明し、電解液への添加が一般的になっています。フルオロエチレンカーボネートを添加した場合は、SEI中のLiFが増加することが報告されています。
これらの化合物を添加すると、電解液の溶媒としてPCを使用することも可能になります。
LiPF6は加水分解し易く、PO3Fを生成します。また、熱安定性も悪く、特に充電時の負極など還元状態では60℃程度から分解し始めPF5を生成します。これらのリン化合物はカーボネートと反応します。
VCなどが存在すると、ECなど溶媒同士の反応、溶媒とLiPF6分解物との反応などに優先あるいは競合して添加物との反応が生じ、より良質なSEIが生成することが判明しています。
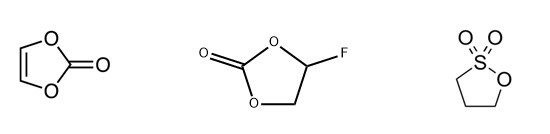
(左から)
ビニレンカーボネート(VC)、フルオロエチレンカーボネート(FEC)、1,3-プロパンスルトン(PS)
以上、LiPF6/EC系の電解液についてまとめてみました。
次回は、スルホンアミド系の電解質、イオン液体を使用した電解液、水系電解液について解説します。
ぜひ、続けてご覧ください
(日本アイアール株式会社 特許調査部 Y・W)