治験薬GMPって何?初心者向けにわかりやすく解説!

医薬品の開発において、治験薬の製造は極めて重要なプロセスです。とりわけ「治験薬GMP」と呼ばれる品質管理のルールは、治験の信頼性と被験者の安全性を担保するための根幹をなしています。しかし、「治験薬GMPとは何か?」という問いに明確に答えられる人は少ないのが実情です。
この記事では、「治験薬GMPの概要」や「関連するガイドライン」さらには「治験薬GMPとGMPの違い」にも触れながら、治験薬GMPの基本をわかりやすく解説します。
目次
1.治験薬GMPとは?
まず、「治験薬GMPとは何か」を押さえておきましょう。
「GMP」とは「Good Manufacturing Practice」の略で、日本では「医薬品及び医薬部外品の製造管理及び品質管理の基準」、「医薬品適正製造基準」などと呼ばれています。
[※関連記事:《医薬品製造関係者の常識》GMPって何?|GMPの3原則など必須前提知識をチェック!]
通常のGMPは承認後の医薬品に対して適用される基準ですが、治験薬に特化したGMP基準として存在するのが「治験薬GMP」です。治験薬は承認前の段階にある医薬品で、安全性・有効性が確立されていません。そのため、治験薬GMPでは、より柔軟な運用が可能でありつつも、信頼性のある品質確保が求められます。
2.治験薬GMPの概要
治験薬GMP(正式名称:「治験薬の製造管理、品質管理等に関する基準」)は、GCP省令(正式名称:「医薬品の臨床試験の実施の基準に関する省令」)の規定に基づき実施される治験で用いる、治験薬に適応される基準です。治験薬GMPで規定されている内容は次のようなものがあります。
- 製造管理・品質管理の体系構築
- 製造記録の保存
- 逸脱・変更管理の実施
- 適切な教育訓練の実施
- バリデーションとキャリブレーション
また、治験薬GMPは、「製造販売承認後の医薬品」のGMPよりも「柔軟な運用」が認められており、特に初期の探索的治験段階(フェーズI)などに対応しやすくなっています。
3.治験薬GMPに関係する各種ガイドライン
治験薬GMPは関係する各種「ガイドライン」も重要な役割を果たします。
厚生労働省医薬食品局が発行する「治験薬の製造管理、品質管理等に関する基準(治験薬GMP)に関する Q&Aについて」では、事例や注意点がQ&A形式で明文化されています。この文書には、製造記録の作成や変更管理、逸脱時の考え方、洗浄バリデーションの注意点など、より実践的な運用指針が示されています。
また、国際的な整合性を担保するために、「PIC/S(Pharmaceutical Inspection Co‑operation Scheme)」のガイドラインも重要です。PIC/Sは、各国の医薬品GMP査察当局が参加する国際的な枠組みで、2014年から日本のPMDAも加盟しています。PIC/Sの目的は、GMP基準と査察制度の国際的な調和を促進することです。
さらに、ICH(国際医薬品規制調和国際会議)のガイドラインも治験薬GMPに関係するガイドラインです。国際共同治験を含むグローバル開発では、これらの基準の整合性を確保することが求められます。
4.治験薬GMPとGMPの違い
治験薬GMPと通常のGMPの違いとは何でしょうか?両者は製造管理や品質管理という観点では共通する部分が多いものの、目的や適用範囲に大きな違いがあります。
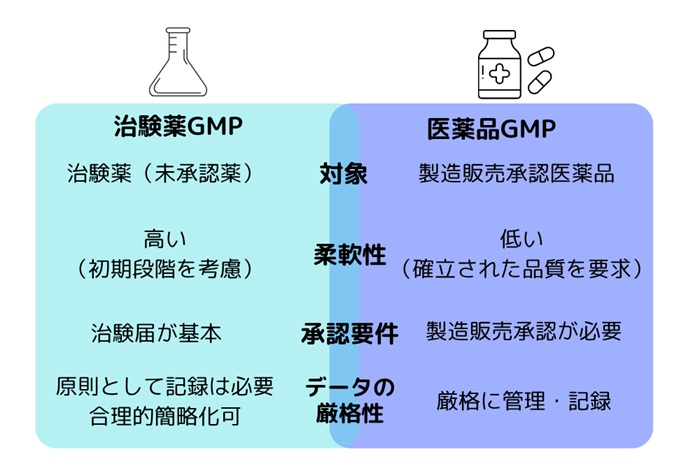
【図1 治験薬GMPとGMPの違い】
治験薬GMPでは、一定のリスク評価に基づき、製造プロセスの一部簡略化と記録要件の合理化が認められることがあります。ただし、これが「品質管理を軽視してよい」という意味ではなく、「被験者の安全を守るための合理的な柔軟性」と理解すべきです。
5.治験薬GMPに求められる体制と教育
治験薬GMPでは特に以下の体制が重視されます。
- 品質保証部門(QA)の独立性
- 製造責任者・品質管理責任者の明確な権限と責任
- SOP(Standard Operating Procedure)の整備と遵守
- 原料・資材の受け入れ管理
- 試験記録とロットリリース判定の明確化
実際の監査では、これらがきちんと運用されているかどうかが厳しくチェックされます。
治験薬製造に関わるには、治験薬製造ラインで無菌操作や設備の取り扱いについての教育訓練を受けなければなりません。しかし治験薬は製造回数が少ないため、現場教育のタイミングを逃す人が出ることが課題でした。
その課題への対応例として、武田薬品ではクリーンルームを再現したVRを導入し、仮想空間で手技を繰り返し練習できる仕組みを整備しています*1)。
VRを使えば製造スケジュールに左右されずに教育ができ、時間とコストの両方を圧縮できます。VRの導入事例は少なく発展途上の技術ですが、今後は治験薬製造の教育手段の一つとして広がることも期待されています。
6.近年のトレンド
(1)リスクベースアプローチの導入
最近のGMP運用においては、「リスクベースアプローチ」の導入が推奨されています。これは、製品や工程の特性に応じて重点的に管理すべきリスクを特定し、リソースを効率的に配分する考え方です。治験薬GMPでも、初期の探索的フェーズでは柔軟に対応し、後期(フェーズIII以降)では市販薬に近いレベルの管理を行うといった段階的な品質管理が望まれています。
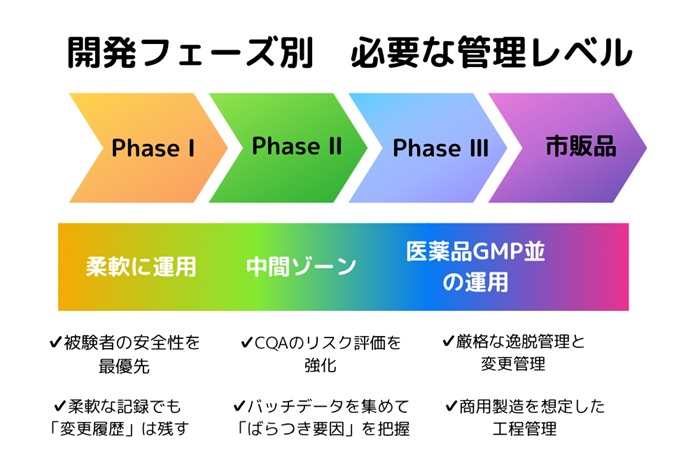
【図2 リスクベースアプローチ】
(2)デジタル技術の活用
2025年1月、臨床試験の国際ルールである「ICH E6(R3) GCP」が正式公開されました。新しいGCPではリスクベースアプローチに加えて、デジタル技術の活用が明確に示されています。国内のGCPガイダンスも順次この内容に合わせて見直される見込みですが、治験薬GMPそのものが直ちに改正されるわけではありません。当面は現行ルールを守りつつ、新ガイドラインのエッセンスを少しずつ取り入れていくという状況です。
[※関連記事:GCP省令とは?ICH-GCP、GCPガイダンスなど混同しがちな用語も含めて解説 ]
記録のデジタル化は、記録を作成する時間を削減するだけでなく、記載ミスも減らせます。たとえばバイオ医薬品メーカーでは、記録のデジタル化を行ったところ、年間3000ページ以上の紙を節約し、記録にかかる時間の削減により年間2バッチの追加生産が可能と見積もられました*2)。
治験薬の製造時は工程の変更が頻発しますが、変更履歴は開発初期から厳格に管理しなければなりません。デジタル化を進めると変更履歴がしっかり残るので、記録ミスによる逸脱を避けられます。
7.まとめ:治験薬GMPの理解は成功する治験の第一歩
治験薬GMPとは、治験薬の品質と安全性を確保するために不可欠なルールです。各種ガイドラインや国際的な基準に沿って適切に管理運用することが、信頼性の高い治験データの確保につながります。特に治験薬GMPとGMPの違いを理解し、製品のライフサイクルに応じた適正な管理を実現することが、医薬品開発全体の質を左右します。
セミナー受講がおすすめ
治験薬GMPの実務は複雑であり、常に最新の知見が求められます。法令改正や国際的な動向も踏まえた深い理解を得るためには、専門家による講義や事例解説が非常に有効です。当サイトでは、治験薬GMPに関する実践的なセミナー情報もご案内しております。現場での対応力を高めたい方、これから治験薬の製造に携わる予定の方は、ぜひご参加ください。
(日本アイアール株式会社 特許調査部 S・O)
《引用文献、参考文献》
- 1) Ansers News(WEBサイト) 武田薬品、製造DXで「作業時間11万時間削減」…データとテクノロジーで目指す「予測型工場」
https://answers.ten-navi.com/pharmanews/28704/ - 2) Rockwell Automation(WEBサイト) バイオ医薬品のパイオニアがMESを導入
https://www.rockwellautomation.com/ja-jp/company/news/case-studies/biopharmaceutical-mes.html