比熱とは何か?公式と求め方、単位、比熱一覧、計算例まで総まとめ解説

物質の熱的性質を表す代表的な指標の一つに「比熱」(specific heat)があります。
比熱は、日常的な温度変化の理解から、機械・熱交換器の設計、空気や金属の熱特性解析に至るまで、幅広い分野で重要な役割を果たしています。
本記事では、「比熱とは何か」について理解できるように解説しつつ、「単位」「求め方」「公式」などについても詳しく説明します。
目次
1.比熱とは
「比熱」とは、単位質量(1kg)の物質の温度を1K(1℃)上げるのに必要な熱量を意味します。つまり物質に加えられた熱量と温度上昇の関係を表す量です。単位は J/(kg·K) です。
比熱は、物質の「温まりやすさ」や「冷めにくさ」を数値で表したものです。
例えば、同じ熱量を加えても、水は金属より温度が上がりにくいことが知られています。これは水の比熱が大きいためです。
「比熱が大きい」ということは、「同じ熱量を与えても温度が上がりにくい=多くの熱を蓄えることができる」という意味になります。
比熱容量と熱容量の関係
また、比熱は「比熱容量」(specific heat capacity)と呼ぶ場合もあります。
比熱容量と混同しやすい物理量として「熱容量」(heat capacity)があります。熱容量はある物質の温度を1℃上げるために必要な熱量のことで、物質の質量が大きければ熱容量も大きくなります。単位は J/K です。
つまり、熱容量は物質全体の熱的性質を表すのに対し、比熱容量(比熱)は物質固有の性質を表す指標ということができます。
熱容量と比熱容量(比熱)の関係は以下の式で表されます。

2.比熱の単位と関連する公式
比熱の単位にはかつてはカロリー単位(kcal/kg·℃)が使われていました。
現在では国際単位(SI)のジュール毎キログラム毎ケルビン(J/kg·K) を用います。
[※関連記事:機械設計者が知っておくべきSI単位の基礎知識|換算方法・使い分けなど総まとめ!]
比熱と物質の温度変化の関係を基本的な公式は次式のようになります。

(2)式を変形すると、比熱容量(比熱)は次式のように表されます。
![]()
比熱を実際に求めるには、ある物質に既知の熱量を加えたときの温度変化を測定します。
たとえば、1kgの物質に4200Jの熱を加えた結果、温度が1K上がった場合、その物質の比熱は
c = 4200/(1×1) = 4200 J/kg-K です。
このようにして求められた値は、物質の種類によって大きく異なります。
水は4200J/kg·Kと非常に高く、金属類は一般に小さい傾向にあります。
3.比熱が大きいとはどういうことか?
比熱が大きいとはつまり、「同じ熱量を加えても温度が上がりにくく、熱量を除去した場合に温度が下がりにくい」ということを意味します。
これは物質内部で熱エネルギーが吸収されて熱が伝わりにくいためと考えられます。
つまり比熱が大きい物質は、同じ熱量の出入りに対して温度が変化しにくい性質を持ちます。
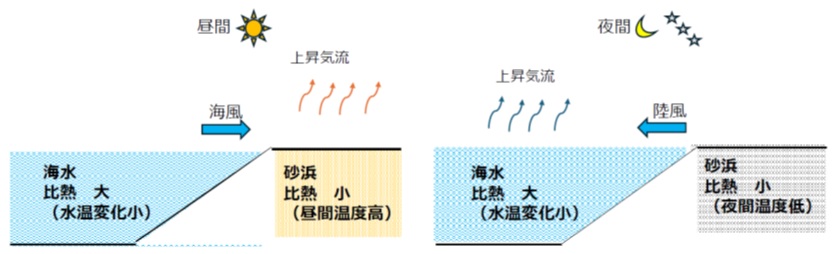
たとえば、海水は陸地よりも比熱が大きく、昼夜の気温変化に対する水温変化は比較的穏やかです。
一方で砂は比熱が小さいため、日中にすぐ熱くなり、夜間には急速に冷えます。
この性質が下図のような「海風・陸風」という気象現象にも関係しています。
海水温と砂浜の温度が平衡する朝夕には朝凪・夕凪という風の止む時間帯があります。
主な物質の比熱一覧
比熱は物質固有の性質であり、数値を見ることで温度変化の起こりやすさを比較できます。
ここでは、水や金属、気体など、代表的な物質の比熱値を一覧表として示します。
【表1 比熱一覧(代表的な物質の比熱値)】
|
物質 |
比熱 [J/kg·K] |
備考 |
| 水 | 約4200 | ほかの物質に比較して非常に大きい比熱を持つ |
| 空気 | 約1000 | 温度・圧力に依存して変化する |
| 銅 | 約385 | 比熱が小さく熱伝導率が高い(熱を伝えやすい) |
| アルミニウム | 約900 | 金属の中では比較的大きく、熱を伝えにくい |
| 鉄 | 約450 | 銅よりやや大きい |
| 氷 | 約2100 | 水より小さいが金属より高い |
| 木材 | 約1700 | 含水率により変化する |
この「比熱一覧」からも分かるように、水は金属に比較して比熱が大きいため、温度変化しにくい物質といえます。
4.比熱の計算例 ― 銅とアルミニウムの比較
上の表からもわかるように、物質によって比熱の値には大きな差があります。
では実際に、比熱が異なることでどの程度温度変化が違うのかを、銅とアルミニウムを例に(2)式を用いて計算してみましょう。
条件:
- 加える熱量 Q=900J
- 質量 m=1kg
銅の場合:比熱385
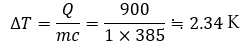
アルミニウムの場合:比熱900
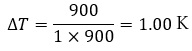
同じ熱量を加えても、銅はアルミニウムより温度上昇が大きいことが分かります。
つまり、アルミニウムは銅より比熱が大きいため、温度変化が緩やかになります。
5.定圧比熱と定容比熱 ― 気体の比熱は2種類
気体の比熱には、「定圧比熱」と「定容比熱(または定積比熱)」という2つの種類があります。
それぞれ、どの条件で加熱するかによって値が異なります。
- 定容比熱(Cv):
体積を一定に保った状態で1K温度を上げるために必要な熱量です。このとき、外部への仕事(膨張)は行われません。 - 定圧比熱(Cp):
圧力を一定に保ったまま温度を1K上げるために必要な熱量です。一定の圧力下で熱を受けると、気体は膨張して外部へ仕事をするため、定圧比熱は定容比熱よりも大きくなります。
これらの関係は次の式で表されます。
![]()
ここで Rは気体定数(gas constant) = 8.31[J/mol·K] です。
【気体定数の単位記号に用いるmolについて】
6.02×1023 個(アボガドロ定数)の粒子(原子、分子)を含む系(熱力学で対象とする物質の集まりのこと)の物質量を1molといいます。
標準状態(0°、1気圧)において気体の種類によらず、1mol=22.4リットルになります。
6.モル熱容量とは?
熱力学、気体力学ではmolを基準にした比熱(モル熱容量)も用いられます。
「モル熱容量」とは、気体1モルあたりの温度を1K上げるのに必要な熱量を指します。単位は J/mol·K です。
定容比熱、定圧比熱に対応して、それぞれ定容モル熱容量Cmv、定圧モル熱容量Cmpがあります。
モル熱容量は、物質の分子レベルでの熱の受け取りやすさを表す数値です。
つまり定圧比熱 Cpを、モルあたりに換算したものが「定圧モル熱容量Cmp」となり、物質ごとに固有の値を持ちます。
理想気体では一例として下表のような値となります。
|
気体 |
Cmp [J/mol·K] |
κ(比熱比) |
| 空気(主にN₂, O₂) | 約29 | 1.4 |
| 一酸化炭素(CO) | 約29 | 1.4 |
| 二酸化炭素(CO₂) | 約37 | 1.3 |
このように、気体によって定圧比熱容量Cmpの値は異なります。
そして、この Cpと定容比熱 Cvの比を取ったものが、次に紹介する「比熱比(κ)」です。
7.比熱比κの意味
気体では、「比熱比κ(カッパ)」という重要な無次元量が使われます。
比熱比はγ(ガンマ)を用いて表すこともあります。
比熱比は、定圧比熱と定容比熱の比(=定圧モル熱容量と定容モル熱容量の比)として次式のように定義されます。
![]()
比熱比は、気体の断熱変化における物理量変化を調べる際に必要となる数値です。
たとえば、空気の比熱比はおおよそ 1.4 で、この値は音速や断熱圧縮・膨張の計算に広く使われています。
エンジンのサイクル解析や空力設計では、温度・圧力変化を求める際にこの比熱比が重要な役割を果たします
比熱比を使った計算例 ― 断熱圧縮による温度上昇
気体の比熱比κは、断熱過程の温度変化を求める際に重要なパラメータです。
ここでは、空気を断熱圧縮したときの温度上昇を例に計算してみましょう。
【条件】

【公式】
断熱圧縮の温度変化は次式で表されます。
![]()
【計算】
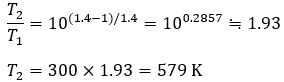
【結果】
空気を10倍の圧力まで断熱圧縮したとき、温度は初期の300K(27℃)から 約579K(約306℃)まで上昇します。
圧縮比が同じ場合、比熱比κが大きい気体ほど、断熱圧縮したときの温度上昇は大きくなります。
たとえば、二原子分子である空気はκ≒1.4、一原子分子であるHeはκ≒1.67で、後者の方が同じ圧縮比に対する温度上昇はより顕著となります。
8.おわりに
比熱は簡単に言えば「熱のたまりやすさ」を表す指標ですが、その背後には熱移動や分子運動に関する物理的意味が隠されています。
空気、金属、水など、様々な物質の比熱を理解することで、熱機関の設計、材料選定、環境制御など、熱と温度に関する工学的課題を解決する手がかりともなります。
(日本アイアール株式会社 特許調査部 S・Y)