医薬品GxPとは?混乱しがちなGLP・GCP・GMPなどの違いを総整理【一覧表あり】

医薬品業界に関わるようになると、必ずと言っていいほど耳にするのが「GLP」「GCP」「GMP」といった言葉です。
これらはまとめて「GxP」と呼ばれますが、
- 種類が多すぎて覚えきれない
- 名前が似ていて違いが分からない
- なぜこんなに細かく分かれているのか腑に落ちない
と感じている方も多いのではないでしょうか。
本記事では、初心者の方でもわかりやすいようにGxPの全体像を整理したうえで、GLP、GCP、GMP、QMS、GCTP、GQP、GVP、GPSP、GDPという主要なGxPを紹介します。
目次
1.そもそもGxPとは何か?
GxPとは、「Good x Practice(適正●●実施基準)」の総称です。
「G」はGood(適正な)、「P」はPractice(実施基準)を意味し、「x」には対象となる業務内容として、さまざまな文字が入り、Clinical(臨床)、Manufacturing(製造)など、どの工程における「Good Practice」かを示しています。
GxPの本質は、製品そのものの出来栄えではなく、その製品に関わる試験や製造などの各工程が信頼できる(同じ材料で同じ工程を踏めば同じ結果になる、すなわち、その工程は客観的で再現性があること)かを保証することにあります。
医薬品や医療機器は、人の生命や健康に直接関わるものです。偶然うまくいった製品では意味がなく、「いつ・誰が・どこで作っても同じ品質になる」ことが求められます。そのため各工程を信頼できるものにするために共通のルールや手順が求められ、GxPとして整備されてきました。
なぜGxPはこれほど多いのか?
GxPが多くて混乱する理由は、医薬品等のライフサイクルが非常に長く、工程ごとにリスクが異なるからです。
代表的な流れは以下の通りです。
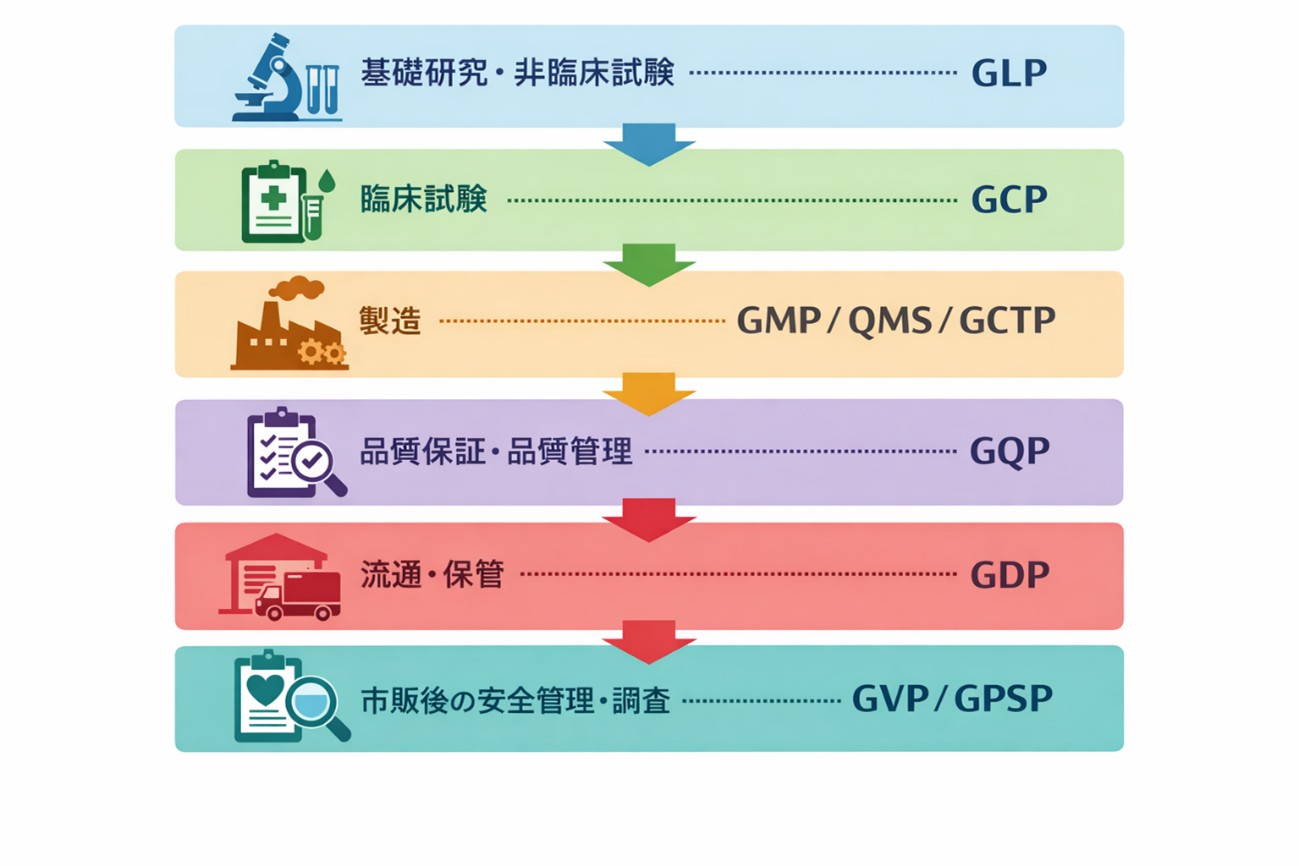
【図 GxPのフローチャート】
各段階で起こりうる問題はまったく異なります。そのため、「すべてを一つのルールで管理する」のではなく、工程ごとに最適化されたGxPが作られてきました。
以下で各GxPを確認していきましょう。
2.GLP(Good Laboratory Practice)とは
GLPは、非臨床試験(主に動物試験など)に関する実施基準(*1)です。
医薬品等を人に投与する臨床試験に進む前に、まずは動物や試験管内で毒性試験、薬理試験、薬物動態試験を行い、その安全性を確かめる必要があります。非臨床試験のデータは、臨床試験に進めるか(人に投与しても安全か)どうかを判断する極めて重要な根拠になります。
GLPが重視するポイントは、
- 試験が計画どおりに実施されているか
- データが正確に記録・保存されているか
- 第三者が後から検証できるか
という点です。
GLPは「良い結果を出す」ことを求めるものではなく、その試験が信頼できる(同じ試験対象に同じ試験をすれば同じ結果が出る)方法で行われたかを保証するためのルールです。
(*1)非臨床試験のうち、毒性試験、一部の(安全性)薬理試験(中枢神経系・呼吸器系・心血管系などの生命維持に重要な影響を及ぼす器官系における被験薬の作用を確認する試験)について、GLPを遵守すべき試験とされています。
[※関連記事:《非臨床試験のルール》GLPの概要・早わかり解説 ]
3.GCP(Good Clinical Practice)とは
GCPは、臨床試験(治験)に関する実施基準です。
臨床試験では実際の患者や健康成人が被験者となるため、GCPの最大の目的は次の2点に集約されます。
- 被験者の人権・安全・福祉の保護
- 得られるデータの信頼性の確保
インフォームドコンセント(十分な説明と理解にもとづく同意)、治験実施計画書の遵守、モニタリング、監査など、多くの要件がありますが、すべては「人を対象とする研究として当然守るべきこと」を体系化したものです(*2)。GCPは倫理性と科学性の両立を強く意識したGxPだと言えます。
(*2)GCPといった臨床試験に関する基準は、ニュルンベルグ綱領(第二次世界大戦でドイツが行った非人道的な実験にもとづく裁判において、臨床研究で遵守すべき事項をまとめたもの)を受けて採択されたヘルシンキ宣言がその背景にあります。
[※関連記事:GCPの概要・早わかり解説 ]
4.GMPとGCTP
(1)GMP(Good Manufacturing Practice)とは
GMPは、主に医薬品・医薬部外品の製造に関する基準です。
どんなに良い薬でも、「製造方法がバラバラ」「衛生管理が不十分」「作った人によって品質が変わる」といった状態では、患者に安心して届けることはできません。
GMPでは、常に同じ品質の製品を安定して製造するための仕組みをつくるために、原材料の受入、製造設備の保守・校正、製造・試験の手順書や記録の整備、バリデーション(*3)の実施、教育訓練など、製造に関わるあらゆる要素が管理対象となります。
GMPの特徴は、
- 品質において、出荷前の最終検査結果だけではなく製造工程も重視する
- 製造・試験の手順書や記録を品質保証の根拠とする(データとして残す)
- 「人が注意する」よりも「(ミスしないような)仕組みをつくる」ことでミスを防ぐ
という点にあります。
GMPは「品質は製造工程でつくりこむ」という考え方を体現したGxPです。
(*3)バリデーション:その製造方法(手順・設備など)で、狙った結果(品質)を安定して出せることを検証し、それを文書化すること
[※関連記事:GMPって何?|GMPの3原則など必須前提知識をチェック! ]
(2)GCTP(Good Gene, Cellular, and Tissue-based Products Practice)とは
GCTPは、主に再生医療等製品(細胞・遺伝子治療等)の製造に関する基準です。
再生医療等製品は従来の医薬品とは異なり、
- 原材料(細胞)の個体差が大きい
- 生きた細胞を扱うため培養環境や加工工程の影響を受けやすい
- 生体内に導入することも多く、高い無菌性が求められる
といった特徴を持つため、専用のGxPが設けられています。
参考:医療機器QMS(Quality Management System)について
QMSは、医療機器に限らず自動車でも食品でもITでも使われる「品質管理システム」という一般概念(GxPのように一工程に着目した形ではなく、システムという組織的な仕組み)ですが、医療機器分野ではISO 13485(*4)をベースに作成された規制要件(QMS省令)として、主に医療機器または体外診断用医薬品の製造に関する基準(*5)を定めています。
QMSはGxP(Good x Practice)の形ではありませんが、GxP的な要件として扱われることも多いです。
(*4)ISO 13485:医療機器に特化した品質マネジメントシステムの国際規格で、消費者が利用するさまざまな製品を幅広く対象としたISO9001規格をベースに、設計検証・バリデーション、製造プロセスの管理、リスクマネジメントなど、医療機器特有のより厳格な要求事項が追加されています。
(*5)QMS省令は、従来は製造業者に求められていた基準でしたが、平成26年の薬機法改正により、GQP省令(の医療機器の製造販売業者に係る部分)の内容などが取り込まれ、製造販売業者が遵守すべき基準となっています。製造販売業者はQMS体制省令にもとづき、製造所の監督等を行うことが必要となっています。
5.GQP(Good Quality Practice)とは
GQPは、製造販売業者(メーカー)における品質保証の実施基準です。
GMPが「工場での製造」を中心にしているのに対し、GQPでは、
- 製造委託先の管理(製造所の監査・監督など)
- 出荷判定(メーカーによる市場に出してよいかの最終判断)
- 品質情報への対応(収集・評価・改善)
など、市場に製品を出す責任を負う立場としての品質管理を求めます。
たとえ、その医薬品等を製造するのは委託した工場等であったとしても、「医薬品等を市場に出す最終責任は製造販売業者にある」という考え方がGQPの根底にあります。
6.GVP(Good Vigilance Practice)とは
GVPは、市販後(製造販売後)の安全管理に関する実施基準です。
医薬品等は、承認時点ですべてのリスクが見えているわけではありません。治験は人数も条件も限られている一方、市販後は年齢、併用薬、基礎疾患、生活環境など、より多彩な条件で使われるため、市場に出てから初めて分かる副作用等もあります。
そのため、医薬品等が市場に出てからも安全管理が義務付けられています。
GVPでは、
- 安全性情報(副作用情報など)の収集・提供
- 安全対策の立案
- 副作用などが発生した際などの規制当局(厚生労働省・PMDAなど)への報告
といった活動を通じて、医薬品等の市販後も患者の安全を継続的に守ることを目的としています。
7.GPSP(Good Post-marketing Study Practice)とは
GPSPは、使用成績調査や製造販売後臨床試験といった市販(製造販売)後調査を適切に実施するための基準です。
GPSPを遵守した調査で収集された資料は、
- 再審査・再評価(医薬品・再生医療等製品が対象)
- 使用成績評価(主に医療機器、体外診断用医薬品が対象)
といった制度で製造販売後の安全性の再確認に活用されています。
GVPが「安全性情報を集めて評価する仕組み」だとすると、GPSPは「市販後の安全活動として行う調査や研究の質(信頼性)を担保する仕組み」と考えると良いかもしれません。
8.GDP(Good Distribution Practice)とは
GDPは、医薬品等の流通・保管に関する実施基準です。
製造された製品も、「温度管理が不適切」「偽造品が混入」「輸送中に品質が劣化」してしまっては意味がありません。
GDPでは、
- 適切な条件での保管(温度管理など)
- 取り違え・混同の防止
- 汚染・破損・盗難の防止
- トレーサビリティ(製品がいつ・どこからどこへ動いたかを追跡できる仕組み)
などによって、それらを防止します。
GDPは、製造から患者の手に渡るまでの品質を守るためのGxPです。
9.GxPを工程と紐づけて整理【一覧表まとめ】
GxPは医薬品等のライフサイクルと紐づけることで、理解しやすくなります。
・どの工程のルールか
・何を目的としたものか
を意識しましょう。
【表 主なGxPのまとめ】
| 主な対象工程 | 主に何を目的としたものか | |
| GLP | 非臨床試験(動物実験) | 試験の信頼性 |
| GCP | 臨床試験(治験) | 被験者の保護、治験の信頼性 |
| GMP | 医薬品・医薬部外品の製造 | 医薬品・医薬部外品の品質の一定性 |
| GCTP | 再生医療等製品の製造 | 再生医療等製品の品質管理(無菌性など) |
| GQP | 製造販売 | 製造販売業者による医薬品等の品質の保証(製造販売業者が医薬品等を市場に出す責任) |
| GVP | 市販後(製造販売後) | 市販後における医薬品等の安全性 |
| GPSP | 市販後(製造販売後)調査 | 市販後における調査の信頼性 |
| GDP | 流通 | 流通段階での品質維持 |
おわりに
GxPは単なる規制の集合ではなく、患者の安全と医薬品等への信頼を守るために積み重ねられてきたものです。
全体像を理解すれば一つひとつが意味を持っていることがわかります。
本コラムが、GxPに対する理解の第一歩となれば幸いです。
(日本アイアール株式会社 特許調査部 Y・A[薬剤師])