《医療機器と法規制》薬機法の定義と分類|プログラム医療機器(SaMD)の法規制は?

前回まではデジタルヘルスの事例についてご紹介してきましたが、今回はこれからデジタルヘルス業界に参入しようとする時に知っておきたい医療機器に関する法規制についてご紹介したいと思います。
目次
1.医療機器とは何か?(薬機法での定義)
私たちの周りを見回すと、さまざまな医療機器に囲まれていることがわかります。
家庭の中では体温計や血圧計などがありますし、病院の中ではメスやハサミといった手術に使う器具から、CTやMRIといった非常に大きな装置まで種々の医療機器が診断や治療に活用されています。
日本の法律では、「医療機器」について、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」1)[通称:医薬品医療機器等法(薬機法)]によって以下のように定められています。
「医療機器」とは、人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等(再生医療等製品を除く。)であつて、政令で定めるものをいう。
わかりやすくまとめると、
- 1) 人間または動物に用いる
- 2) 疾病の診断・治療・予防に使用されること、または、身体の構造・機能に影響を及ぼすことが目的とされている
上記の全てに当たるものが「医療機器」に該当するとされ、薬機法施行令別表第1では、6つの類別(機械器具・医療用品・歯科材料・衛生用品・プログラム・動物専用医療機器)に106種類の名称が定められており、4446種類の一般的名称に細分化されています(2023年2月現在)。2)
2.医療機器は使用目的によって該当するかどうか決まる
例えば、身近なハサミについて考えてみると、家庭内では文房具として販売されているハサミを紙を切るのに使いますが、これは人間や動物に使用しないので、薬機法の定義に当てはめると、もちろん「医療機器」には該当しません。
これに対して、床屋さんや美容室では、文房具と違って切れ味が鋭い特殊なハサミを使用しています。人間の髪を切ることを目的としているので上記の1)の項目に当てはまりますが、疾病の診断・治療・予防に使用されること、または、身体の構造・機能に影響を及ぼすことを目的としていないので、これも「医療機器」に該当しません。
同じ「ハサミ」であっても、医師が手術などに使う「医療用はさみ」(薬機法施行令類別名称)に限って「医療機器」に該当するのです。
3.人体へのリスクの大きさによって製造販売の手続きが異なる
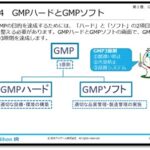
「医療機器」の製造や販売が法律で規制されている理由としては、使用法を間違えたり不具合があったりすると人体の生命や健康に大きな影響を及ぼす、という医療機器の性格があります。
そこで、人体へのリスクが大きいと考えられる医療機器がより慎重な審査によって製造販売が行われるように、医療機器の種類によっていくつかの分類に分けられており、それぞれの分類で製造販売の手続きが異なります。3)
以下、リスクが小さいものから順にご紹介します。
(1)クラスⅠ(一般医療機器)
クラスⅠ(一般医療機器)は、不具合が生じた場合でも、人体へのリスクが極めて低いと考えられるものが該当します。
例: 体外診断用機器、聴診器など
このクラスの医療機器は、製造会社が自身で認証し、独立行政法人医薬品医療機器総合機構(PMDA)に「届出」するだけで製造販売できます。
(2)クラスⅡ(管理医療機器)
クラスⅡ(管理医療機器)は、不具合が生じた場合に、人体へのリスクが比較的低いと考えられるものが該当します。
例: 電子体温計、電子血圧計など
認証基準がある場合、製造会社は第三者認証機関に「申請」し、同機関で「審査」および「認証」を行います。
(3)クラスⅢ(高度管理医療機器)
クラスⅢ(高度管理医療機器)は、不具合が生じた場合に、人体へのリスクが比較的高いと考えられるものが該当します。
例: 透析機器、放射線治療機器、コンタクトレンズなど
(4)クラスⅣ(高度管理医療機器)
クラスⅣ(高度管理医療機器)は、患者への侵襲性が高く、不具合が生じた場合、生命の危険に直結する恐れがあるものが該当します。
なお、クラスⅢおよびクラスⅣでは、臨床試験の成績をもとに、製造会社が厚生労働省に「申請」し、PMDAが「審査」を行い、厚生労働大臣が「承認」します。
4.ソフトウェア・アプリでも「医療機器」として規制される?
上記では、一般的な「医療機器」の規制分類について解説しましたが、ポイントオブケア(POCT)などデジタル技術を応用した製品であっても同様に適用されます。
従来は、ソフトウェアプログラムがあらかじめ内部に組み込まれた装置や機器が想定されていましたが、最近はデジタル技術の進展によって、スマートフォンなどの汎用デジタル機器に後からインストールして用いるプログラム(ソフトウェアアプリ)であっても従来の医療機器と同様に、病気の診断・治療を目的としたものが開発されるようになってきました。
そこで、平成25年の薬機法改正によって単体のプログラムについても薬機法の規制対象として規定されました。
厚生労働省が作成したガイドライン4)によると、薬機法の規制対象となるプログラムは、「医療機器としての目的を有しており、意図したとおりに機能しない場合に患者(又は使用者)の生命及び健康に影響を与えるおそれがあるプログラム(ソフトウェア機能)」とされており、従来のクラスⅡ以上の医療機器に相当するものです。
このような医療機器として規制対象となるプログラムは、「プログラム医療機器」(Software as a Medical Device:SaMD)と呼ばれています。
5.プログラム医療機器(SaMD)の法規制上の課題
プログラム医療機器は、デジタル製品であるために、一般的な医療機器と比べて製造や保管、物流にかかるコストが少なく参入の障壁が低いことから、これまで医療機器の製造と縁のなかった業種を含めて多くの企業が開発に乗り出すと考えられます。
しかし、プログラム医療機器特有の新たな課題として、医療機器に該当するか分かりにくいといった点などが浮上してきています。
例えば、一般の人の健康増進のために食事や運動の内容や成果を日々記録する「フィットネスアプリ」は医療機器には該当しませんが、高血圧患者を対象に、食事や運動量および血圧を記録して生活の改善につなげる「血圧治療用アプリ」5)は医療機器に該当します。
「医療用はさみ」の事例のように、似たような機能を持った製品でも、対象となる人の選択や介入の程度によって、医療機器の該当性や分類が変わることがしばしば起こるのです。
開発したデジタルヘルスアプリがプログラム医療機器に該当するかどうかによっては、健康保険の診療報酬による開発費用の回収が可能になるなど、ビジネス戦略に大きく影響します。
デジタルヘルスへの参入を計画している企業は、最新の規制動向を是非チェックしてみて下さい。
6.プログラム医療機器の実用化促進のための新しい施策について
「プログラム医療機器」などの最先端の医療機器は、これまで日本国内で審査の事例があまりないため、審査の考え方や申請に必要なデータを含めて、現在は官民ともに手探りの状況にあります。
また、特に人工知能を活用した医療機器の場合、使用データの蓄積によって日々機能がバージョンアップする性質があります。
このようなプログラム医療機器の特性を踏まえた効率的な審査を実施するため、厚生労働省は、相談窓口の一元化を含めた新しい施策「プログラム等の最先端医療機器の審査抜本改革(DASH for SaMD)」6)を公表しています。
次回は、プログラム医療機器の審査改革について、海外の動向も含めて紹介したいと思います。
(アイアール技術者教育研究所 A・S)
≪参考文献・引用文献≫
- 1)e-Gov法令検索(薬機法)
https://elaws.e-gov.go.jp/document?lawid=335AC0000000145 - 2)独立行政法人医薬品医療機器総合機構HP(医療機器の一般的名称等一覧)
https://www.std.pmda.go.jp/scripts/stdDB/conf/stdDB_confjmdn.cgi - 3)独立行政法人医薬品医療機器総合機構HP(医療機器)
https://www.pmda.go.jp/review-services/drug-reviews/about-reviews/devices/0028.html - 4)厚生労働省HP(プログラムの医療機器該当性に関するガイドライン)
https://www.mhlw.go.jp/content/11120000/001082227.pdf - 5)株式会社CureAppニュースリリース[PR TIMES](2022年4月27日)
https://prtimes.jp/main/html/rd/p/000000090.000015777.html - 6)厚生労働省HP(DASH for SaMD)
https://www.mhlw.go.jp/content/11124500/000737470.pdf