【手順書購入割引付】 医療機器リスクマネジメントセミナー【提携セミナー】
おすすめのセミナー情報
もっと見る| 開催日時 | 【Live配信受講】 2025/3/26(水) 13:30~16:30 , 【アーカイブ配信受講】 2025/3/31(月) まで受付 (配信期間:3/31~4/11) |
|---|---|
| 担当講師 | 村山 浩一 氏 |
| 開催場所 | 【WEB限定セミナー】※会社やご自宅でご受講下さい。 |
| 定員 | - |
| 受講費 | 【Live配信受講】【アーカイブ配信受講】共通 通常申込:本体50,000円+税5,000円 E-Mail案内登録価格:本体50,000円+税5,000円 【ライブ配信+アーカイブ配信】 価格:66,000円 |
【手順書購入割引付】
医療機器リスクマネジメントセミナー
≪難解な品質リスクマネジメントを初心者にも分かりやすく解説≫
【提携セミナー】
主催:サイエンス&テクノロジー株式会社
受講可能な形式:【Live配信】【アーカイブ配信】【Live配信+アーカイブ配信】
受講証明書/修了証を無料で発行いたします。
※お申し込み時に通信欄に「受講証明書発行希望」とご記載ください。
※受講証明書発行には下記条件が必須となります。
・ライブ配信:参加率80%以上
・アーカイブ配信:期間終了後に発効
【受講特典】
●当セミナーでご紹介する手順書や様式を割引価格で購入することができます。
【ここがポイント】
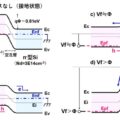
■医療機器業界におけるリスクとは
■ISO-14971:2019とは
■ISO-14971:2007とISO-14971:2019の差異について
■ISO-14971:2019逐条解説
■設計管理のインプットとしてのリスク分析の実施方法とは
■ユーザビリティエンジニアリングとは
■リスクマネジメントとユーザビリティエンジニアリングの違いは?
■工程設計とリスクマネジメントの関係
■リスクを管理するための具体的なSOPとは
セミナー趣旨
医療機器企業にとって、リスクを管理することは非常に重要です。しかしながら、リスクマネジメントは難解です。
医療機器業界では、欧州が先行し、90年代からIOS-14971が制定されました。
医療機器には何がしかのリスクが潜んでいます。リスク分析の結果は、設計管理のインプットとなります。
医療機器事故は、ユーザの意図した利用と設計者の思想のギャップによって起こるとされています。
昨今では、ユーザビリティを含め、合理的な誤使用を予測したリスク分析が求められています。
演者は多くの医療機器企業においてリスクマネジメントの指導を行ってきましたが、各社ともに我流で実施していることが多いようです。
それでは、医療機器の安全が確保できず、また回収(改修)も減少しません。
そのためには、リスクマネジメントの基本的な考え方と規制当局の期待を十分に理解しなければなりません。
本セミナーでは、難解なリスクマネジメント・ISO-14971:2019を初心者にもわかりやすく解説いたします。
担当講師
(株)イーコンプライアンス 代表取締役 村山 浩一 氏
【関連の活動など】
日本PDA 第9回年会併催シンポジウム 21 CFR Part 11その現状と展望
日本製薬工業協会 医薬品評価委員会 基礎研究部会主催(東京)
東京大学大学院医学系研究科 臨床試験データ管理学講座などにて多数講演。など
セミナープログラム(予定)
1.リスクとは
・「リスク」って何でしょ?
・起きてしまったことはリスクとは言わない
・品質苦情、CAPAとFTAの関係性
・「リスク」って何でしょ?
・リスクの定義(ISO/IEC Guide 51)
・R-MAP法とは?
・リスク評価の実際(R-Map法)
・危害の程度
・発生頻度
・重大性と発生確率の低減
・リスク発生に対する考え方
2.用語の定義
・用語の定義
3.安全とは
・ISO/IEC Guide 51: 2014 “Safety aspects ー Guidelines for their inclusion in standards”
・ISO/IEC Guide 51: 2014 安全とは
・航空機はなぜ飛ばせることができるのか?
・発生頻度のゼロレベル
・発生頻度
・どうやって安全にするか ~3 step method~
・リスク低減方策の優先順位
・初期リスクアセスメントでは、発生確率はあまり重要ではない
・リスクコントロール後は発生確率に注目する
4.合理的に予見可能な誤使用とは
・合理的に予見可能な誤使用
・ISO/IEC Guide 51: 2014 製品の使用条件とリスクアセスメントの範囲
・合理的に予見可能な誤使用の検討
・ISO 14971とIEC 62366の適用範囲
・誤使用と使用エラーについて
・使用エラー
・異常使用
5.リスクマネジメントとは
・医療機器リスクマネジメントとは?
・一般的なリスクマネジメントプロセス
・ハザード、危害、リスク
・リスクマネジメントのライフサイクルモデル
・リスクマネジメント
・リスクシナリオ
・ISO 14971:2019 表C.1-ハザードの例
・【例】PCプロジェクターにおけるリスクアセスメント
・ヒューマンエラー、ソフトウェアエラー
・機器設計リスクマネジメントワークシート
・医用電気機器(ME機器)とは ~メカ・エレキ・ソフトウェアの設計開発~
・機器設計機器要求事項とリスク分析の関係
・state of the artとは
・改良医療機器におけるリスクマネジメント
・リスクマネジメントワークシート
・ISO 14971:2019の要求事項を正確に理解するために
・医療機器の設計においてFMEAは使用してはならない
・製造工程におけるリスクマネジメント(FMEA)と設計工程におけるリスクマネジメント(ISO 14971)は何が異なるのか?
・IVD製品のリスクモデル
6.ISO 14971:2019とは
・ISO-14971 (JIS T 14971) 「医療機器-リスクマネジメントの医療機器への適用」 とは
・ISO14971:2019(JIS T 14971)規格の適用範囲
・ISO 14971誕生の歴史
・ISO14971:2019(JIS T 14971)規格とは
・ISO14971:2019 目次
・テクニカルレポート(TR)とは
・テクニカルレポートとは
・ISO/TR 24971 医療機器-ISO 14971適用の指針とは
・ISO/TR 24971:2020(TR T 24971:2020)規格とは
7.リスクマネジメントシステムの一般要求事項
・ISO 14971:2019 4. リスクマネジメントシステムの一般要求事項
・ファイルとは
・ISO 14971:2019 4. リスクマネジメントシステムの一般要求事項
・リスクマネジメント計画
・ISO 14971:2019 4. リスクマネジメントシステムの一般要求事項
・ファイルとは
8.リスクアセスメント
・リスク分析
・ISO 14971:2019 5. リスク分析
・【例示】医療機器の意図された使用(リスク分析シート1)
・ISO 14971:2019 5. リスク分析
・特性・特質分析
・【例示】安全性に関する特性(リスク分析シート2)
・ISO 14971:2019 5. リスク分析
・【例示】合理的に予見可能な誤使用(リスク分析シート3)
・ハザードではないもの
・ISO 14971:2019 5. リスク分析
・リスク評価
・ISO 14971:2019 6. リスク評価
9.リスクコントロール
・ISO 14971:2019 7. リスクコントロール
10.全体的な残留リスクの評価
・全体的な残留リスクの評価
・ISO 14971:2019 8. 全体的な残留リスクの評価
11.リスクマネジメントのレビュ
・リスクマネジメントのレビュ
・ISO 14971:2019 9. リスクマネジメントのレビュ
12.製造及び製造後の活動
・なぜ継続的な臨床評価が必要か?
・ISO 14971:2019 10 製造および製造後の活動
・state of the art(最新の技術水準)とは
・ISO 14971:2019 10 製造および製造後の活動
13. 製造工程とリスクマネジメント
・リスク分析手法(主なもの)
・リスク分析手法の特長と使用方法
・欠陥モード影響解析(FMEA:Failure Mode Effective Analysis)
・欠陥モード影響解析(FMEA)
・機能リスクアセスメントの実施方法
・重大性/確率/検出性(SPD)
・リスク優先度(RPN)とは
・乾燥工程におけるFMEA実施例
・FMEA実施時の留意事項
※内容は予告なく変更になる可能性があります。
公開セミナーの次回開催予定
開催日
【Live配信受講】 2025年3月26日(水) 13:30~16:30
【アーカイブ配信受講】 2025年3月31日(月) まで受付 (配信期間:3/31~4/11)
開催場所
【WEB限定セミナー】※会社やご自宅でご受講下さい。
受講料
【Live配信受講】【アーカイブ配信受講】共通
通常申込:本体50,000円+税5,000円
E-Mail案内登録価格:本体50,000円+税5,000円
【ライブ配信+アーカイブ配信】
価格:66,000円
※当セミナーは、E-mail案内登録価格の適用はございません。定価のみでの販売となります。
★【S&T会員登録】と【E-Mail案内登録】の詳細についてはこちらをご参照ください。
※E-Mail案内登録をご希望の方は、申込みフォームのメッセージ本文欄に「E-Mail案内登録希望」と記載してください。ご登録いただくと、今回のお申込みからE-mail案内登録価格が適用されます。
配布資料
- Live配信受講:PDFテキスト(印刷可)
※セミナー資料は、電子媒体(PDFデータ/印刷可)を主催者サイトのマイページよりダウンロードいただきます。
(開催前日を目安に、ダウンロード可となります)
※ダウンロードには、会員登録(無料)が必要となります。
備考
- 講義中の録音・撮影はご遠慮ください。
特典
【セミナー関連手順書のご案内】
【ISO14971対応】品質リスクマネジメント規程・手順書・様式
ダウンロード版:94,050円(税込)
手順書等を正式に発行される場合は、ご購入いただくことを推奨いたします。
ご購入いただいた場合、1年間の無料更新をご提供いたします。(修正や規制要件の改正などに対応いたします。)
またご質問に定義ご回答いたします。
ご購入はこちらからお願いします。
セミナーご受講者様は、クーポンコードをご入力いただくことで特典価格でご購入いただけます。
具体的な購入方法については、セミナー配信時にご案内させていただきます。
お申し込み方法
★下のセミナー参加申込ボタンより、必要事項をご記入の上お申し込みください。
★【LIVE配信】、【アーカイブ配信】、【LIVEとアーカイブ両方視聴】のいずれかから、ご希望される受講形態をメッセージ欄に明記してください。