ゲノム編集技術の主な改良・応用技術を解説[dCas/nCas/転写調節など]

前回の「基礎からわかるゲノム編集」では、ゲノム編集の開発の歴史と主なゲノム編集ツールZFN、TALEN、CRISPR/Cas9の基本知識について解説しました。
今回はさらにゲノム編集技術の改良・応用技術についてもご紹介します。
目次
1.ゲノム編集による遺伝子のノックアウト・ノックイン
ZFN、TALEN、CRISPR/Cas9などのゲノム編集ツールでDNA二本鎖切断(DSB)を誘導しますが、DNA二本鎖切断(DSB)は細胞にとって有害なため、細胞内のDSB修復経路によって修復されます。
この修復機構を利用して遺伝子ノックアウト・ノックインが行われます。
修復機構には相同配列を利用する経路(相同配列依存的修復:HDR)と相同配列を利用しない経路(非相同末端結合修復:NHEJ修復)があります。
NHEJ修復過程において修復エラーが生じて挿入・欠損変異(indel変異)が起こることが知られています。
この性質を利用してフレームシフトや終止コドンを誘発し、挿入や欠失による遺伝子ノックアウトが行われます(図1:左側)。
また遺伝子ノックインの場合、例えばHDRの中で相同組換え修復(HR修復)を利用し、ゲノム中の標的配列へDSBが導入されると、HR修復によりドナーベクターの外来遺伝子が挿入されます(図1:右側)。
HDRにはMMEJ修復やSST-Rを利用したノックイン法、NHEJ修復を利用したノックイン法などもあります。
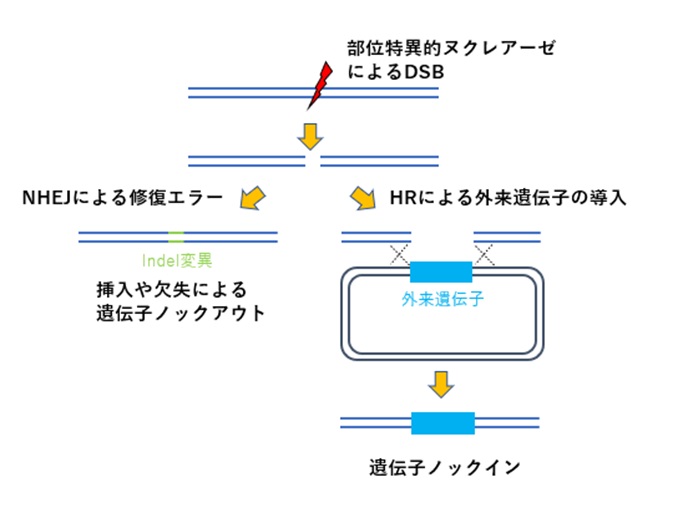
【図1:ゲノム編集による遺伝子ノックアウト・ノックインの一例】
2.CRISPR/Cas9の改良
ゲノム編集では標的配列に似た配列が存在する場合、標的配列以外の切断が誘導される「オフターゲット作用」が生じ、ゲノム編集を行う際の問題点となります。
そのため、オフターゲット作用を抑え特異性を高める技術開発が進んでいます。
① dCas
CRISPR/Cas9システムでは、ガイドRNA(gRNA)と相補的な配列をもつDNAにCas9が結合し、結合部位が切断されます。
Cas9には2つのヌクレアーゼドメインがあり、gRNAが結合する標的配列を切断するHNHドメインと、非標的配列を切断するRuvCドメインがあります。通常これら2つのヌクレアーゼドメインでDNAのそれぞれの鎖に切れ目を入れることにより、DSBを生じさせます。
Cas9の2つのヌクレアーゼドメインに変異を導入した不活性型Cas9(dCas9; dead Cas9)は、切断活性を持ちませんが、gRNAを介したゲノムDNAの結合能力は残っているため、FokIヌクレアーゼと連結したdCas9-FokIとし、ペアで使うと特異性の高い編集が可能となります(図2)。
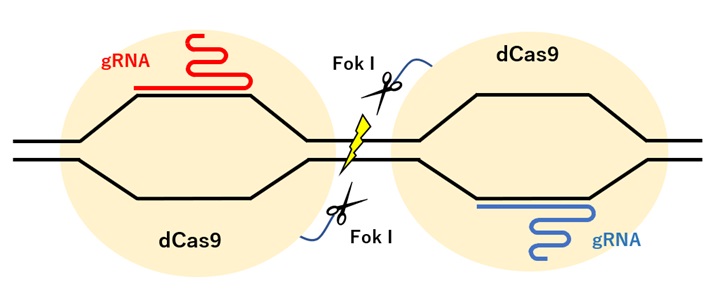
【図2:dCasを用いたゲノム編集】
② nCas
Cas9のヌクレアーゼドメインどちらか一方に変異を導入したニッカーゼCas9(nCas9; nickase Cas9)はDNAの一方の鎖にのみ切れ目を入れることができます。
nCas9をペアで使うと、各々のnCas9が近接するDNA鎖に切れ目を入れDSBを誘導します。2つのnCas9によりDSB誘導を起こすことで、特異性の高い編集が可能となります(図3)。
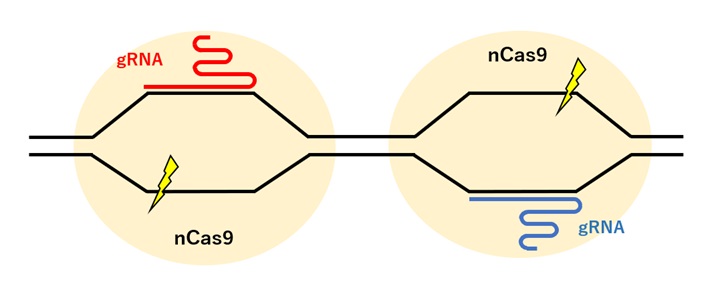
【図3:nCasを用いたゲノム編集】
3.ゲノム編集の応用技術
ゲノム編集は標的配列を切断する技術として開発されてきましたが、標的配列にタンパク質を結合させることを利用して、遺伝子のノックアウト・ノックインだけではなく、転写調節などの応用技術として発展してきています。
① 転写調節技術
遺伝子発現は、特異的DNA配列を認識して結合する転写調節因子によって、転写が正負に制御され行われています。
切断活性を欠失させたdCas9に3種類の転写活性化因子(VP64/p65/Rta)を融合させた改変Cas9(dCas9-VPR)と、標的遺伝子のプロモーターあるいは転写開始点に近接した領域に設計したgRNAを導入すると、標的遺伝子の転写開始点に転写活性化因子が作用することで活性化し、CRISPRa(CRISPR activation)と呼ばれています(図1)。
逆に、dCas9を標的配列に結合させて転写を抑制するCRISPRi(CRISPR interference)、dCas9と転写抑制ドメインを融合させて転写を抑制することもできます。
このように、切断活性を欠失させdCas9と別のタンパクを融合させることにより、転写活性制御だけでなく、ゲノム上の任意の領域にエピジェネティックな修飾したり、機能ドメインを集積したりゲノム機能を調節できる様々なツールとして利用可能となります。
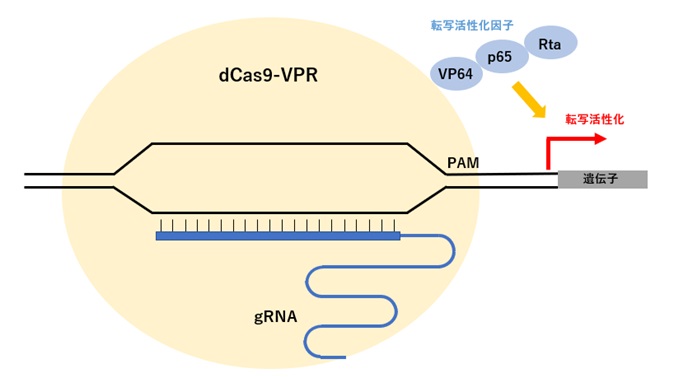
【図4:改変Cas9による転写活性制御】
② デアミナーゼを利用した点変異ゲノム編集技術
従来のゲノム編集がヌクレアーゼによるDNA二本鎖を切断するのに対して、塩基変換酵素を用いる事で二本鎖を切断せずに点変異を導入する技術が開発されています(図5)。
ヌクレアーゼ活性を不活性化したCas9(dCas9またはnCas9)を塩基変換酵素と連結させることによって点変異を導入するTarget-AIDは、塩基変換酵素としてシチジンデアミナーゼを利用することでシトシン(C)の脱アミノ化によってウラシル(U)に変換されます。
RNA塩基のウラシル(U)がDNA上ではチミン(T)として認識されるため、シトシン(C)がチミン(T)に変換されます。
欠失・挿入などが入り混じるDNAの切断を伴うゲノム編集と比較して、塩基編集は基本的には点変異のみを生じ、より正確で精密な編集が期待できることから医療分野への応用が注目されています。

【図5:デアミナーゼを利用した点変異ゲノム編集】
4.ゲノム編集技術の課題と今後
画期的な技術として、さまざまな分野で注目を集めるゲノム編集技術ですが、未だ発展途上であることは否めません。
狙った箇所とは異なる箇所が切断される「オフターゲット変異」は、ゲノム編集技術最大の課題といえるでしょう。特に、ヒトの体細胞にゲノム編集を行う場合、がん化のリスクは否定できません。ゲノム編集の医学応用には「オフターゲット変異」のコントロールが実用化の鍵となるでしょう。
急速に発展を遂げるゲノム編集技術ですが、CRISPR/Cas9が生み出されたことでさらなる盛り上がりを見せています。CRISPR/Cas9は、新型コロナウイルスの研究用検査薬にも用いられており、最新の製品にもすばやく活用されている技術です。
医学領域においても、ゲノム編集技術に特化した製薬企業もでてきています。
今後、ゲノム編集技術は医学において、なくてはならない技術となることは間違いないでしょう。
次回は、実際にゲノム編集を利用した医療や農林水産分野での技術についてご紹介します。
(日本アイアール株式会社 特許調査部 N・Y、S・N)








































