《コラーゲンの基礎知識》構造、栄養、機能|ゼラチンとの違い|食べても効果ナシ説は本当?

皆さんは「コラーゲン」という用語を目にすることが多いと思いますが、その実体をご存じでしょうか?
また、ゼラチンの原料はコラーゲンであることをご存じでしょうか?
今回のコラムでは、コラーゲンとその関連物質であるゼラチン、コラーゲンペプチドについて解説します。
目次
1.コラーゲンとは?
「コラーゲン」は、皮膚、靱帯、骨、軟骨、血管などの構造を担う高分子の構造タンパク質であり、皮膚や骨、軟骨、腱などの結合組織の主成分として存在しています(人体のタンパク質全体の約30%)。特に動物の皮膚の大部分を占める真皮は、主にコラーゲン線維からできています(約70%)。
コラーゲンは古くから皮革、にかわ、ゼラチンなどとして広く利用されてきました。
また、フカヒレ、手羽先、牛スジ、豚足などの食材にコラーゲンが多く含まれています。
なお、魚のアラや鶏の手羽先、牛豚の「もつ」を煮た後、冷えて固まる「煮こごり」もコラーゲンが分解したゼラチンが固まったものです。
近年、機能性食品(コラーゲンドリンク)や化粧品の成分、医薬用品としても盛んに利用されています。
2.コラーゲンの構造
(1)一次構造
コラーゲンは、アミノ酸がペプチド結合で多数結合したタンパク質の一種です。
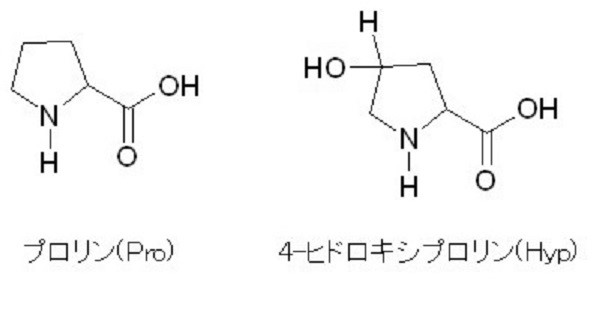
そのアミノ酸組成は、他の一般的なタンパク質と異なり、グリシン(Gly)が全アミノ酸残基の約1/3、イミノ酸(プロリン(Pro)とヒドロキシプロリン(Hyp))が約2/9を占め、フェニルアラニン(Phe)、トリプトファン(Trp)、ヒスチジン(His)のような疎水性アミノ酸残基はほとんど存在しません。
コラーゲンのアミノ酸配列の特徴は、以下の通り3アミノ酸配列の繰り返しになっている点です。
-Gly-X-Y-
(Gly=グリシン、X=プロリン、Y=ヒドロキシプロリン、アラニンまたはヒドロキシリジン)
X、Yは任意のアミノ酸ですが、XにはPro、YにはHypが高頻度で出現します。
コラーゲンの種類によりX、Yを占める頻度は異なっています。
(2)二次構造
アミノ酸のつながりであるポリペプチド鎖は、鉛筆を芯にしてそのまわりに針金を巻き付けてできるような形(αらせん、αヘリックス)を好んでとります。
コラーゲンは、ほとんどの場合、「α鎖」と呼ばれるα-ヘリックス構造を持つポリペプチドが三つ重なり合った、特徴的な三重らせん構造持っています。具体的には、各ポリペプチド鎖が左巻きのポリプロリンII型様の構造をとり、一残基ずつずれてグリシン残基が中央に来るようにペプチド鎖が3本集まって緩い右巻きの螺旋構造をとります。
上記の通り、3アミノ酸配列の繰り返し(Gly-X-Y)構造が特徴ですが、三本鎖は、プロリンとヒドロキシプロリンのもつ環状構造であるピロリドン環により安定化されています。
3本の鎖は水素結合により繫がっていますが、水素原子の供給源はグリシンのアミノ基であり、受容源はほかの鎖残基のカルボキシル基です。ヒドロキシプロリンのカルボキシル基も水素結合に関与しています。
なお、コラーゲン分子の両末端にはランダム構造(二次構造の一つ)が存在し、「テロペプチド」と呼ばれています。この部分は、酵素作用を受けやすく、抗原作用に関与しています。
(3)三次構造
コラーゲン分子が、少しずつずれて沢山集合し、太く長いコラーゲン細線維(collagen fibril)を作ります。これは「コラーゲン原線維」とも呼ばれます。このコラーゲン細線維の太さは通常、数十〜百数十 nm程度で、透過型電子顕微鏡で観察することができます。この太さは、コラーゲン線維を作っているコラーゲンの各型の割合やプロテオグリカンなどによって決まることがわかっています。
コラーゲン細線維は、さらに多くが寄り集まって、結合組織内でコラーゲン線維(膠原線維)(collagen fiber)を形成します。コラーゲン線維の太さは数μm~数十μmで、適切な染色をおこなうと、光学顕微鏡でも観察することができます。
さらにコラーゲン線維が集合してコラーゲン線維束(collagen fiber bundle)を形成する場合があります。
3.コラーゲンとゼラチン、コラーゲンペプチドの関係
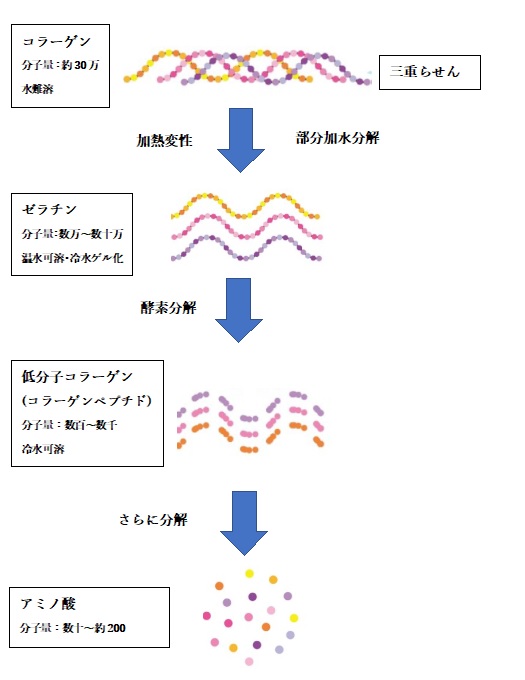
コラーゲンを加熱変性して高次構造をほぐしたものが「ゼラチン」であり、さらに酵素などで細かく分解したものが「コラーゲンペプチド」です。これらの関係を模式的に示すと以下の通りです。
なお、コラーゲンペプチドは健康補助食品として利用されており、一般的な消費者は「コラーゲンペプチド」のことを「コラーゲン」と呼んでいることが多いようです。
4.コラーゲン、ゼラチンの利用
(1)コラーゲンの用途
現代でもコラーゲンは様々な用途に利用されています。
身近な例としては、化粧品、ソーセージケーシングなどの可食性食品包装材が挙げられますが、医療分野でも人工角膜、火傷の被覆材、手術時の癒着防止材、止血剤、塞栓剤、生体接着剤、手術用糸、人工血管、人工骨、人工皮膚、ドラッグデリバリーシステム(薬剤徐放)、細胞移植担体、iPS細胞培養基材など、広く利用されています。
クリーム、乳液、化粧水などの化粧品に使用されるコラーゲンは、牛や豚の皮、また魚皮などから抽出された可溶性コラーゲン(若齢動物の真皮は可溶性コラーゲンを比較的多く含みます。不溶性コラーゲンを酵素処理により可溶化したものがアテロコラーゲンで、さらに酸処理により可溶化したものや脂肪酸基で修飾したタイプがあります)で、その効果は保湿効果と使用感の向上です。保湿効果を高めるには、コ ラーゲンが常に水に溶解しておりよく水和していることが重要とのことです。
(2)ゼラチンの用途
ゼラチンは、古代エジプトや古代中国では接着剤である膠(にかわ)として利用されていました。
膠は現在でも絵画、墨、木製の楽器、研磨紙、製本、貼箱、紙器などに利用されています。

ゼラチンの利用で最も身近な例は、ゼリーやグミキャンディーと思いますが、ヨーグルト、プリン、マシュマロ、ムース、ババロア、冷凍食品(餃子など)、ハム、ソーセージなどの食品素材の他、ハードカプセル、ソフトカプセル、ミニカプセル、シップ剤、錠剤、トローチ、座薬、止血剤などの医薬品製剤素材、写真フィルム、レントゲンフィルム、印画紙、印刷材料などとしても利用されています。
なお、ゼラチンの特徴は、加熱・冷却によって、ゼラチン溶液がゾルからゲル、ゲルからゾルに相変化することです。これを模式的に示すと以下の通りです。
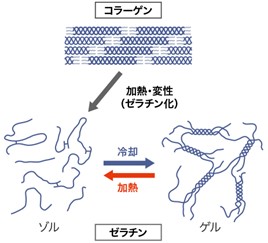
(※新田ゼラチン社のHPより転載)
[URL:https://www.nitta-gelatin.co.jp/ja/labo/gelatin/05.html ]
5.コラーゲン、ゼラチンの栄養価
食品として摂取されたコラーゲンやゼラチンは、そのまま吸収されず、消化の過程で分解され、バラバラになった状態でアミノ酸として体内に吸収されると考えられていました。
コラーゲン、ゼラチンをアミノ酸源として考える場合、グリシンやイミノ酸が非常に多い反面、必須アミノ酸であるトリプトファンが欠けているため、アミノ酸バランスが悪く、プロテインスコア(タンパク価)は極めて低いということになります。
しかし、他のタンパク質に不足する必須アミノ酸供給源として活用することで、食品としてより有効に働きます。例えば、ゼラチンにはリジンが比較的多く含まれているので、リジンが制限アミノ酸になっている米や小麦粉とゼラチンを合わせて摂取することで、栄養補足効果があらわれます。
6.コラーゲンペプチドの機能性(コラーゲンの効果)
「コラーゲンを食べても肌に効果はない?」という議論があります。
コラーゲンを食べると消化酵素によりアミノ酸にまで分解されて小腸で吸収されると考えられていました。
確かにコラーゲンを経口摂取しても特定の組織や皮膚にコラーゲンのまま吸収されることはない、というのが定説でした。
しかし、近年、一部の低分子コラーゲン(コラーゲンペプチド)はそのまま吸収される場合があること、皮膚、骨、軟骨などの細胞を刺激して機能を活性化/抑制したり、増殖を促進し、コラーゲン合成能を活性化する可能性があることがわかってきました。経口摂取されたコラーゲンペプチドは体中の至る所に運ばれ、シグナルを発して新しいコラーゲン細胞を作り出していると考えられています。
以下、コラーゲンペプチド摂取の作用(文献あり)の一部を抜粋してご紹介します。
- 骨に対する作用: ゼラチンやコラーゲンペプチドの経口摂取により、骨密度が低下した状態で、これを上昇させた。
- 関節への作用: コラーゲンペプチドを含む飲料を24週摂取した結果、関節痛が有意に低下した。
- 皮膚への効果: 乾燥などによる肌荒れを自覚している女性に4週間摂取させた結果、1日当たり5g以上の摂取で角質層水分量が有意に増加した。
- 爪への効果: 1日7gのゼラチンを摂取した結果、脆い爪が改善された。
- 毛髪への作用: 1日14gのゼラチンを摂取した結果、毛髪が太くなった。
- 血圧への作用: 高血圧自然発症ラット(SHR)にコラーゲンペプチドを投与すると、血圧が低下した。
- 血中脂質への作用: ラットに1日当たり0.166g/㎏のコラーゲンペプチドを摂取させると、血液中の中性脂肪が有意に低下した。
コラーゲンペプチドの機能性に関する特許文献の例
最後に、コラーゲンペプチドの機能性(生理作用)に関する特許情報の例をいくつかご紹介します。
- 特許4490498「疾病抑制剤」
- 特許5199919「ヒトデコラーゲンペプチドを有効成分とする血糖値上昇抑制剤およびヒトデコラーゲンペプチドの製造方法」
- 特許5612131「糖尿病の治療または予防剤」
- 特許5872763「白内障予防食品」
もちろん、これ以外の関連文献が多数存在しています。ご興味のある方は調査してみましょう。
ということで今回は、知っておいて損はない「コラーゲンの基礎知識」を解説しました!
(日本アイアール株式会社 特許調査部 A・A)
<参考文献>
- 1)「天然素材コラーゲンの機能性」 小山洋一 皮革科学 56:71-79 (2010)
- 2)「生体高分子コラーゲンの新しい利用」宮田 暉夫 日本家政学会誌 40(8) :725-731(1989)
- 3) コラーゲンの構造 – 皮革用語辞典 https://dictionary.jlia.or.jp/detail.php?id=684
- 4) 日本ゼラチン・コラーゲン工業組合 ホームページ https://www.gmj.or.jp/collagen/collagen-peptide.html
- 5) Pochop D. J. et al., Lancet, 2, 527-528 (1962), ” Gastrointestinal absorption and renal excretion of hydroxyproline peptides”
- 6) Iwai K. et al., J. Agric. Food Chem. 53, 6531-6536(2005) ,“Identification of Food-Derived Collagen Peptides in Human Blood after Oral Ingestion of Gelatin Hydrolysates”
- 7) Ohara H. et al., J. Agric. Food Chem., 21;55(4):1532-5 (2007), ” Comparison of quantity and structures of hydroxyproline-containing peptides in human blood after oral ingestion of gelatin hydrolysates from different sources”
- 8) Shigemura Y. et al., J. Agric. Food Chem. 57, 2, 444–449 (2009), ” Effect of Prolyl-hydroxyproline (Pro-Hyp), a Food-Derived Collagen Peptide in Human Blood, on Growth of Fibroblasts from Mouse Skin”
- 9) Nakatani S. et al., Osteoarthritis Cartilage 17(12):1620-7 (2009), “Chondroprotective effect of the bioactive peptide prolyl-hydroxyproline in mouse articular cartilage in vitro and in vivo”









](https://engineer-education.com/wp/wp-content/uploads/2021/08/Experimental-design_0-150x150.jpg)