3分でわかる オゾンの生成・分解プロセス|オゾン層破壊に至るメカニズムがわかる

当連載の「3分でわかる フロン冷媒の基礎知識」の回で、冷媒として使われるフロン族に含まれる塩素(Cl)がオゾン層を致命的に破壊し、南極上空のオゾン層に穴(オゾンホール)ができていることが社会問題となったことをとり上げました。
このコラムでは、「オゾン」と「オゾン層」の基礎知識についてご説明します。
1.オゾンの構造と性質
オゾン(ozone)は、3つの酸素原子からなる酸素の同素体で、分子式はO₃です。
気体は水色で、液体は濃い青色、固体は濃紫色を呈しています。
強い酸化剤としてよく知られています。
(1)オゾンの分子構造
オゾンは折れ線型の構造をとっています。
中心の酸素原子と両端の酸素原子の結合は二重結合と見なしてよく、オゾン分子はO−-O+=O (1)とO=O+-O−(2)の2つの極限構造からなる共鳴混成体であると考えられます(図1)。
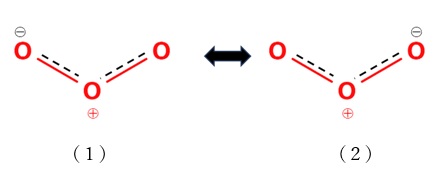
【図1 オゾン分子の共鳴構造】
(2)オゾンの化学性質
オゾンは、主に空気中での紫外線照射、酸素中での無声放電など高いエネルギーを持つ電子と酸素分子の衝突によって発生します(式1)。
3O2⟶2O3 ・・・式1
また、放置しておくと酸素に変化します(式2)。
2O3⟶3O2 ・・・式2
オゾンは、フッ素に次ぐ強力な酸化剤であり、殺菌や漂白など広い場面に用いられます。
2.オゾン層とは
「オゾン層」とは、大気中のオゾンの約9割が存在する成層圏の高濃度オゾン帯のことを指して、高度10–50 km付近と言われています(表1)。
成層圏のオゾン層は、太陽からの有害な紫外線を吸収して、地上の生態系を保護しています。
また紫外線を吸収することで、成層圏の大気を暖める効果があり、地球の気候の形成に大きく関わっています。
【表1 地球の大気層分布】
| 対流圏 | 0-10Km |
| 成層圏(オゾン層) | 10-50Km |
| 中間圏 | 50-80Km |
| 熱圏 | 80-800Km |
| 外気圏 | ~10,000Km |
3.オゾン生成のプロセス
自然界でオゾンを生成する唯一の反応は紫外線照射により行われます。
異なるエネルギーの光子を吸収して、結合と分解を繰り返します。そのエネルギーは、それぞれ酸素分子とオゾン分子の吸収帯に対応する太陽光中の紫外線に当たります。
酸素分子の密度は、空気の密度に比例するので、高度が高くなるほど低くなります。また、紫外線は太陽光の強度に比例するため、高度が高いほど強いです。
オゾン生成はこの両方に依存するため、オゾンの生成する密度の高い場所は成層圏中部の20–30km付近にあたります。
実際、高度20kmより上空のオゾン層では、酸素分子が太陽光中の242nm以下の波長の紫外線を吸収して、光解離が起こることで、酸素分子が分解して酸素原子になります(式3)。この酸素原子が別の酸素分子と結合してオゾンが生成されます(式4)。
生成したオゾンは320nm以下の波長を持つ紫外線を吸収して、2つの酸素分子に分解します(図2、式5)。自然界のオゾンはこの生成と消滅のバランスにより濃度が保たれています。高度20kmより下ではオゾンの生成は殆どありませんが、成層圏内の大気の流れでオゾンが運ばれてきます。※1)
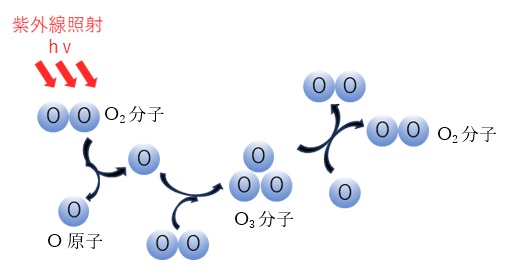
【図2 自然界でオゾンの生成 ※1)】
オゾン生成反応と分解反応
以下の反応式でオゾンの生成反応と分解反応を表します。
O2+hν1⟶ 2O ・・・式3
O+O2+M⟶O3+M ・・・式4
O+O3+hν2⟶ 2O2 ・・・式5
hはプランク定数で、hνは振動数νの光子が持つエネルギーを表しています。
ν1とν2は、それぞれ酸素分子やオゾン分子の吸収帯に対応する紫外線の振動数に当たります。
式4のMは主に窒素や酸素の分子で、反応のエネルギーを受け取るという役割をしています。
なお、46億年前に地球が誕生した当初、原始大気は主に二酸化炭素からなり、酸素分子が殆ど存在しなかったため、オゾン層も殆ど存在しませんでした。
大気中に酸素分子が増え始めたと同時に、オゾンも増え始めたと考えられています。
4.オゾン層の破壊とオゾンホールができるメカニズム
オゾンは、ヒドロキシラジカル、一酸化窒素、塩素原子などの存在によって分解されます。
フロン冷媒中の塩素原子によってオゾン層が破壊されたというのは、その一つになります。
フロンは非常に安定な物質なので、殆ど分解されないまま成層圏に到達します。その後、太陽からの強い紫外線によって分解され、塩素原子ができることでオゾンを分解してしまうのです。
では、なぜ極地上空にオゾンホールができたのでしょうか?
成層圏では、塩素原子はメタンや二酸化窒素等と化合物を作って不活性化しますが、これらの物質は両極に運ばれやすく、低温の冬の南極上空にできる極成層圏雲が触媒となって塩素分子が生成、集積されます。そして、春に融けて活性化した塩素原子が大量発生し、南極の春にあたる9–10月頃に南極のオゾン濃度が急低下することで、オゾンホールができると考えられています。
(日本アイアール株式会社 特許調査部 H・L)
《引用文献、参考文献》
- 1)気象庁HP「オゾン層とは」
https://www.data.jma.go.jp/env/ozonehp/3-10ozone.html