バイオ医薬品DB「パープルブック」とは?特許調査での注意点・利用方法などを解説

パープルブックは、米国で承認されたBiological Product(バイオ医薬品)に関連する米国特許が掲載されているデータベースです。
今回は、パープルブックの概要、特徴、問題点そしてその利用方法などについて紹介します。
目次
1.パープルブックとは?(概要)
「パープルブック」(Purple Book)とは、米国食品医薬品局(FDA)によって安全性と有効性に基づいて承認された全てのバイオ医薬品に関する情報を提供するデータベースです。
固有名や投与方法、承認日等の情報に加え、特許情報も掲載されています。
従来は特許情報が掲載されていませんでしたが、2021年にPublic Health Service Actが改正されたことで、バイオ医薬品に関連する米国特許及び存続期間等の情報が掲載されるようになりました。
2.パープルブックの特許情報について
しかし、パープルブックに特許情報が掲載されているバイオ医薬品は、FDAが承認した全てのバイオ医薬品のうちごく一部に限られます。2023年6月時点でパープルブックに登録されている約600品目の全バイオ医薬品の中で特許情報が掲載されているのはわずか10品目のみです。
では、どのようなバイオ医薬品の特許情報が掲載されているのでしょうか?
特許情報が掲載されているバイオ医薬品は、主にFDAに後発バイオ医薬品(バイオシミラー)の承認申請が行われた先発バイオ医薬品です。
3.バイオシミラー申請時の特許リスト提出手続き
米国では、バイオシミラーの申請者がFDAに略式承認申請を行った後、先発バイオ医薬品メーカーとの間で製造情報や関連する特許リストを交換する「パテントダンス」という手続きが存在します。
パテントダンスでは、まず先発バイオ医薬品メーカーに対してバイオシミラーの申請情報や関連する製造情報を提供します。これらの情報に基づいて侵害された特許が存在すると判断した場合、先発バイオ医薬品メーカーはその特許リストをバイオシミラー申請者へ提出します(42USC262(l)(3)、42USC262(l)(7))。
先発バイオ医薬品メーカーは、この特許リストをFDAに対しても提出する必要があり、FDAはこの特許リストをパープルブックの特許情報として掲載します(42USC262(k)(9)(iii))。
つまり、パープルブックに掲載される特許情報は、先発バイオ医薬品メーカーが、特定のバイオシミラーを開発するバイオシミラー申請者によって侵害されたと考える特許リストです*1)。
4.パープルブックの特許情報における問題点
このようにパープルブックに特許情報が掲載されるのは、一部のバイオ医薬品に限られています。
別コラムで紹介した米国の低分子医薬品DBの「オレンジブック」と比較すると、オレンジブックではFDAが承認した全ての低分子医薬品に関連する特許情報が掲載されていますので、この違いに留意する必要があります。これは、低分子医薬品では特許情報の提出が義務付けられているのに対し、バイオ医薬品ではそのような義務が存在しないためです。
また、パープルブックに掲載されている特許情報は、あくまで既に申請された特定のバイオシミラーとの関係で侵害されたと考える特許リストですので、今後申請される可能性のある他のバイオシミラー製品との関係ではさらに別の特許リストが提出される可能性があります。
さらに、オレンジブックでは、原則、物質特許、製剤特許、医薬用途特許(使用方法等)の3種類の特許情報しか掲載されませんが、パープルブックではバイオ医薬品のパッケージ(包装)に関する特許など医薬品成分と直接関係のない特許も掲載されている可能性があります*2)。
このようにパープルブックの特許情報は、網羅性と正確性に問題がありますので、その点を理解したうえで利用することが好ましいです。
5.パープルブックの利用方法
以下では、Humira® (adalimumab)のパープルブック検索を例に取り上げます。
Humira ®はAbbVie Inc.によって開発された関節リウマチ等の治療に使用される抗TNF-α抗体製剤です*3)。
(1)FDAのパープルブック
パープルブックのサイト(https://purplebooksearch.fda.gov/)にアクセスし、Humiraを検索します。
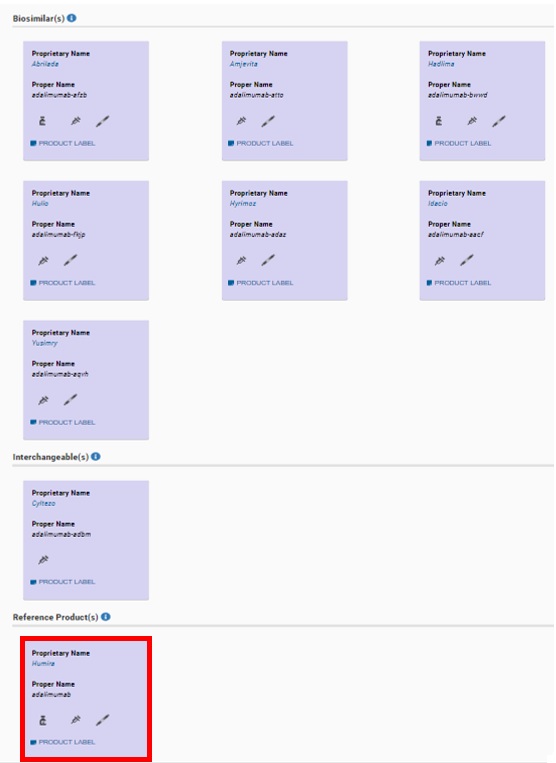
(2)Reference Product(s)
上からBiosimilar(s)(バイオシミラー)、Interchangeable(s)(互換可能なバイオシミラー)、Reference Product(s)(先発バイオ医薬)の順に表記されます。
Humira ®はReference Product(s)ですので、画面中の最下部の赤枠部分に表示されます。
赤枠中の“Humira”をクリックします。

(3)Patent List
Humira®の承認情報の一覧が示されます。
画面中の最下部の赤枠で示す“Patent List Provided”の“YES”をクリックすると、次のようにHumira®に関連する特許情報(米国特許番号、特許存続期間等)が表示されます。
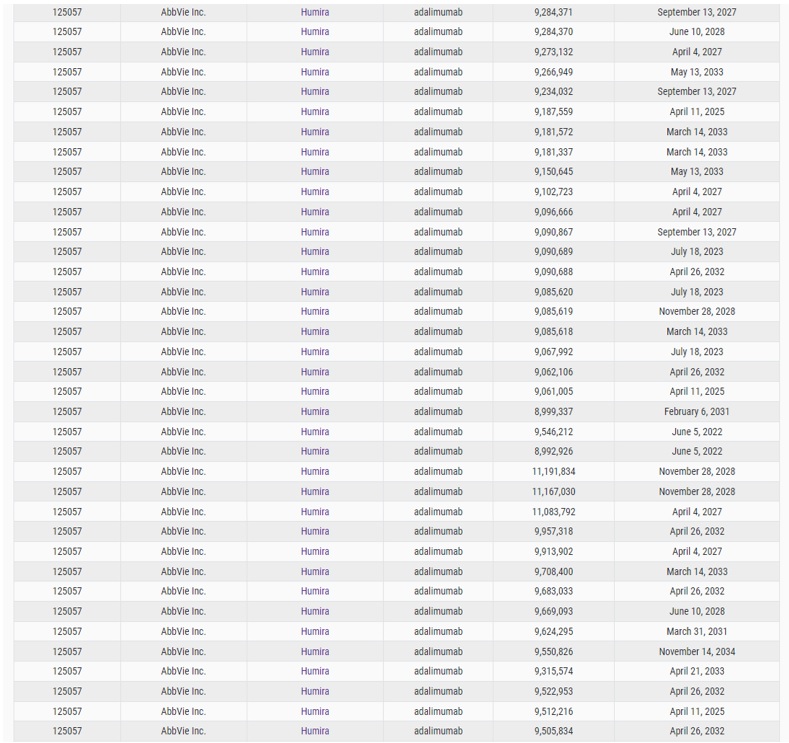
2023年6月時点でHumira®に関連する米国特許が66件掲載されています。これらはHumira®のバイオシミラー申請の際のパテントダンスで提出された特許リストと考えることができます。
これらの特許は抗体組成物、治療方法、抗体産生細胞の培養方法などに関するものであり、多面的に保護されていることが分かります。これらを分析することで、抗体医薬を開発する企業は特許ポートフォリオ構築等の特許戦略を検討する際の参考とすることができます。
6.パープルブックの有用性と注意点
このようにパープルブックを利用することで、特許情報が掲載されている一部のバイオ医薬品については、簡易的な侵害予防調査や特許戦略を策定する際の「参考」にすることができます。しかし、殆どのバイオ医薬品については特許情報が掲載されていませんので、バイオ医薬品一般の特許調査ツールとして使用することはできません。
バイオ医薬品は低分子医薬品に比べ、Humira®のように多数の特許により保護されていることがあり、広範で専門的な特許調査を必要とします。
日本アイアールではお客様のニーズに応じた国内外のバイオ分野の特許調査・分析を行っております。
また医薬・バイオ分野に関連する法律や技術セミナーも多数開催していますので、セミナー情報もぜひチェックしてみてください。
《引用文献、参考文献》
- 1) 諸外国のパテントリンケージ制度に関する調査 報告書 (般財団法人知的財産研究教育財団 知的財産研究所)
- 2) Bryan S. Walsh, Jonathan J. Darrow & Aaron S. Kesselheim(2022). Recent Orange and Purple Book legislation suggests a need to bridge drug and biologic patent regimes, Nat Biotechnol . ;40(2):167-169.
- 3) https://www.humira.com/



 《この記事の執筆者》
《この記事の執筆者》