リチウムイオン電池の負極とインターカレーション、SEIの生成
今回のコラムでは、リチウムイオン二次電池で使用される「負極」について説明します。
目次
電極とリチウムイオンの移動
下図は、リチウムイオン二次電池の模式図です。
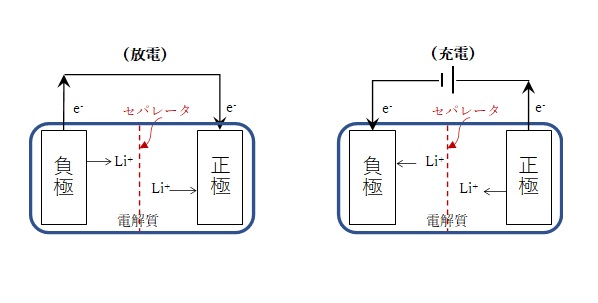
負極(アノード;電子の放出、酸化) ALi → A + Li+ + e– (1)
正極(カソード;電子の受取、還元) Z + Li+ + e– → ZLi (2)
リチウムイオン電池に関する前回の連載コラム「電池の性能指標とリチウムイオン電池」で説明したように、電池として機能するためには、より大きな起電力が発生するように正極(正確には正極活物質)と負極(正確には負極活物質)を選択し、リチウムイオンが媒体中を移動できる必要があります。
リチウムイオン二次電池における電極活物質とは、電極にあってリチウムイオンの酸化還元を行う化合物(上記の式のALi、ZLi)です。
電極には、活物質以外に金属箔からなる集電体やいろいろな添加剤(バインダー、導電助剤など)が含まれています。(活物質以外については、後の連載コラムで説明します。)
さらに、二次電池として機能する(繰返し充放電が可能とする)ためには、電極では移動してきたリチウムイオンの出し入れが繰返しできる必要があります。
1.負極とインターカレーション
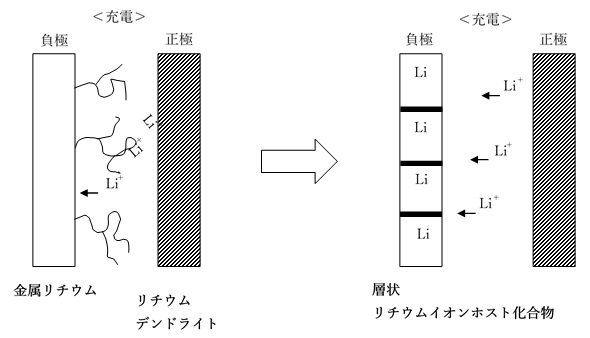
リチウムイオン二次電池の開発初期(1970年代)には、既に実用化されていたリチウム一次電池を引き継いで、負極として金属リチウムが検討されていました。しかし、金属リチウムの負極には充放電効率が低い、寿命が短いという大きな問題がありました。その原因は、充電時に負極上に析出(電着)した金属リチウム結晶が、充放電を繰返すと成長していくためです。成長する結晶の形状が樹枝状に見えるため、「デンドライト」と呼ばれます。リチウムデンドライトが正極に達すると内部短絡する危険性もありました。そのため、実用化には到りませんでした。
Li+ + e– → Li E0=-3.04V(vs H+/H2)
この問題の解決策のひとつが、リチウムイオン(ゲスト)のホスト化合物となることができ、大きな負の標準電極電位を持つ物質の探索でした。
ホスト化合物は一定の高次構造(結晶など)を持ち、その構造を維持した状態でゲスト(リチウムイオン)と反応(挿入・脱離)することができます。負極活物質としてリチウムイオンのホスト化合物となる物質を使用すると、その構造が破壊されなければ、デンドライトの生成を抑制できます。
高次構造を維持したままで、その表面や内部で進行する固相反応を「トポ化学反応」(トポタクティック反応)と呼びます。特に、ホスト化合物が層状化合物の場合、そのトポ化学反応を「インターカレーション」と呼びます。
インターカレーションでは、リチウムイオンは層状化合物(層間化合物)の層間に挿入・脱離します。
(下の模式図を参照して下さい。)
電池容量を大きくするためには、リチウムイオンの挿入・脱離ポイントが多いほど好ましいことになります。
また、リチウムイオンの挿入が起きると電極活物質は膨張し、脱離が起きると収縮します。高サイクルで充放電が可能とするためには、この膨張収縮を小さくすることが重要となります。
2.炭素系負極活物質の基礎知識
現在、負極活物質としては、主としてグラファイト(黒鉛)、ハードカーボンおよびソフトカーボンなどの炭素系物質が使用されています。
2019年度ノーベル化学賞を受賞した3人の研究内容は、電極活物質として層状化合物を使用すること、及びリチウムイオン二次電池の基本的な構成を完成したことでした(Whittingham・・・インターカレーションの電極への応用、Goodenough・・・Liイオン含有金属酸化物正極活物質、吉野・・・炭素系負極活物質・Liイオン含有金属酸化物正極活物質からなる非水電解液系二次電池)。
なお、このLiイオン含有金属酸化物正極活物質(LiCoO2など)も層状化合物です。
(1)グラファイト(黒鉛)
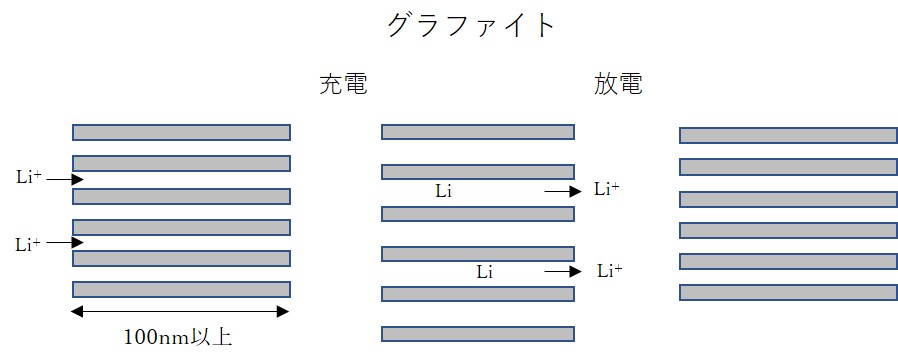
グラファイトは結晶性で、多数のグラフェン層(通常、300層以上)からなる層状化合物です。
リチウムイオンはグラフェン層間に挿入・脱離します。
充電時には、以下のようなリチウムイオンの挿入反応が起きています。
C6 + Li+ + e– → LiC6 E0=-2.90V(vs H+/H2)
グラファイトの理論容量は372mAh/gで、初期放電容量は300~350 mAh/gです。
層間距離は放電時では0.335nmですが、充電時には0.370nm(LiC6)に拡大します。
密度は2.1~2.25g/㎤です。
リジッドな層状構造のため、インターカレーションによる膨張収縮が大きいといえます。
(2)ハードカーボン
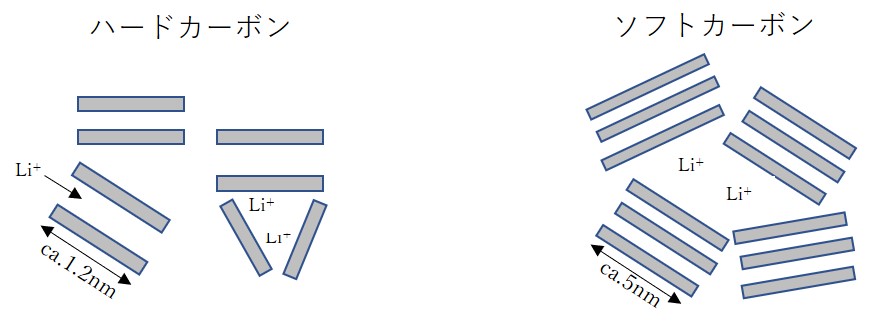
ハードカーボンは「難黒鉛化炭素」とも呼ばれ、高温で熱処理してもグラファイトにならない炭素で、フェノール樹脂などの熱硬化性樹脂を不活性ガス雰囲気で熱処理することにより得られます。
ハードカーボンは結晶子が非常に小さく、グラフェンも数層程度の積層で、かつ乱層構造をとります。
リチウムイオンは層間だけでなく、結晶子間の空隙にも挿入脱離します。
グラファイトと比較して、挿入脱離ポイントが増加します。そのため、グラファイトより単位重量当たりの初回充電電気量は増加します。(ただし、密度は1.5~1.7g/㎤程度なので、単位体積当たりでは低下します。)
また、後述するSEIの生成が増大するため、グラファイトより初期充放電効率が低下し、初回放電容量が大きく低下します。
一方、挿入脱離ポイントの増加により電荷移動による内部抵抗が減少するため、グラファイトより充放電レート特性は向上します。
層間距離は約0.380nmで、乱層構造によりリジッド性も低下するので、充放電による膨張収縮はグラファイトより小さくなります。そのため、容量維持率(サイクル特性、電池の寿命)はグラファイトより向上します。
(3)ソフトカーボン
ソフトカーボンは「易黒鉛化炭素」とも呼ばれ、非晶質部、乱層構造およびグラファイト類似構造部が混在しており、熱処理温度が高温になるほど、グラファイト構造が増加します。
ピッチ系炭素や熱可塑性樹脂を1000~1200℃に熱処理することにより得られます。
層間距離は約0.34nm、密度は1.8~2.0g/㎤程度です。
大まかには、グラファイトとハードカーボンの中間的な特性となります。
グラファイトなどにリチウムイオンがインターカレーションする様子を模式図に示しました。
3.SEI(Solid Electrolyte Interphase)の生成
リチウムイオン二次電池に使用される電解質媒体には、リチウムイオン伝導性に優れ、かつ充放電時に電気化学的に安定である(酸化還元されない、電気分解しない)ことが必要です。
ある電気化学系(電極、電解質、媒体からなる電池など)が電気化学的に安定に存在できる作動電位の範囲を「電位窓」と呼びます。
リチウムイオン二次電池の電解質媒体として一般的に使用されるカーボネート系有機溶媒の電位窓は、1~4V vs Li+/Liです。
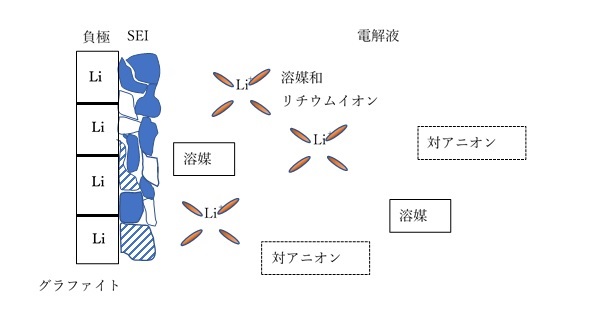
負極の電位(vs Li+/Li)が1Vを下回るとカーボネート系有機溶媒は還元的分解が起き、正極の電位4Vを上回ると酸化的分解が起きます。この時生成する分解生成物、さらにその反応物からなる物質を「SEI」(Solid Electrolyte Interphase)と呼びます(下図を参照)。SEIは非電子伝導性です。
負極がグラファイトの場合、初回充電時の負極電位は約0.1Vなので、界面で接触しているカーボネート系有機溶媒の還元的分解が発生します。負極と電解質溶液との界面に、リチウムアルキルカーボネートなどの有機質やリチウム塩などの無機質からなる、厚さ数~数十nmのSEIが生成します。SEIの生成によりリチウムイオンが消費されるため、初回放電容量は初回充電電気量の約80~95%に低下します(初期充放電効率の低下)。この時失った電池容量を「不可逆容量」と呼びます。
SEIが負極/電解質溶液界面を覆ってある程度の厚さの被膜を形成すると、負極活物質と電解質溶媒が接触し難くなるため、電解液の分解速度は大幅に低下します。2回目以降の充放電では、1回目のような大きな電池容量の低下は生じません。SEIはリチウムイオンの拡散を阻害するため(内部抵抗)、その厚みが影響します。負極に形成されるSEIは充電時に増加(一部の無機質が堆積)し、放電時に減少(有機質が溶解)します。その厚みを一定範囲に保てるようなSEIが形成されるような電解液や負極の設計が必要です。
次回のこの連載コラムでは「炭素系以外の負極活物質」について解説します。
(日本アイアール株式会社 特許調査部 Y・W)















































