リチウムイオン電池の正極活物質① コバルト酸リチウムとマンガン酸リチウム
正極活物質はリチウムイオンの供給源となり、リチウムイオンの放出、受取ができる物質です。
今回は、古くから研究され実用化されている正極活物質であるコバルト酸リチウムおよびマンガン酸リチウムについて説明します。
目次
リチウムイオン二次電池の模式図
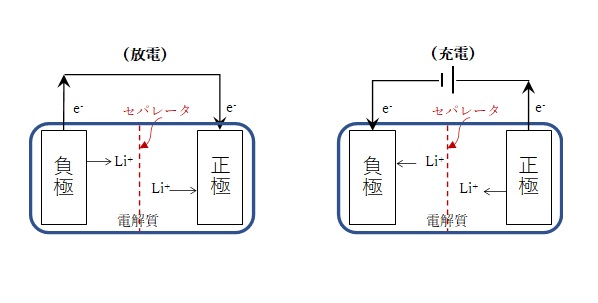
(放電)
負極(アノード;電子の放出、酸化) ALi → A + Li+ + e– (1)
正極(カソード;電子の受取、還元) Z + Li+ + e– → ZLi (2)
※充電では、矢印が逆向きになります。
1.層状岩塩型複合酸化物系正極活物質(コバルト酸リチウム)
各種遷移金属の酸化物からなる層とリチウム層が積層した構造を有する層間化合物です。
インターカレーション型正極として最も古くから研究、実用化されたコバルト酸リチウムLiCoO2を例として説明します。
負極活物質をグラファイトとした電池では、以下の電気化学反応により約3.8Vの起電力が得られます。
CoO2 + LiC6 → LiCoO2 + C6 E0=3.80V (3)
コバルト酸リチウムを用いた場合のメリットとデメリット
正極活物質がコバルト酸リチウムであるリチウムイオン二次電池では、比較的大きな出力が得られます。
製造が比較的容易であることも長所と言えます。
起電力が大きいことは長所ですが、充電時に電解質溶媒の電位窓上限により近づくことになります。
200~300℃で熱分解し、発熱して酸素を放出する点もマイナスです。
安全性に問題があり、過充電(リチウムが過剰に脱離した状態)への対策が必要な点は短所です。
過充電の状態では、以下の反応が起きて酸素が放出されます。
Li(1-x)CoO2 → (1-x)LiCoO2 + 0.5xCo2O3 + 0.25O2 (4)
充電電位が高くなるほど、リチウムの脱離が進み、放出される酸素量も増大します。
一方、正極電位が4Vを超えて上昇すると、電解質溶媒として一般的に使用されるカーボネート系有機溶媒(電位窓:1~4V)の電気化学的な酸化分解が始まり、発熱して電池温度が上昇します。放出された酸素による化学的な酸化分解も発生します。
正極の温度が200~300℃に達すると、コバルト酸リチウムの熱分解も発生し、電解質溶媒との反応も始まります。一時話題になったリチウムイオン二次電池の発火は、こうした電池の熱暴走により発生しました。
過充電に対しては、電池セルに加えて保護回路を加えた電池パックと充電制御回路を有する充電器を組み合わせる方法で対応しています。
加えて、電池温度上昇時に電解質の移動を遮断するセパレータなど化学的な方法も提案されています。
電池容量の急低下や、コスト面でのデメリットも?
コバルト酸リチウムの理論電池容量は274mAh/gです。この理論値は、充電によりリチウムが完全に脱離した場合の値です。
しかし、前記の過充電で説明したように、リチウムの脱離量が多いとコバルト酸リチウムが初期の層間構造を保てなくなり、リチウム挿入量の大幅な減少、電池容量の急激な低下となって現れます。
これも、その構造からくる短所です。実用的に充放電ができる可逆容量は140 mAh/g(2.5~4.2V)です。
また、コバルトは希少金属であり、価格の変動が激しいこともマイナスです。
コバルト酸リチウムはスマートフォン、ノートパソコンなどのデジタル携帯機器用リチウムイオン二次電池に使用されています。
同様な構造の”ニッケル酸リチウム”の場合は?
ニッケル酸リチウムLiNiO2では、可逆容量は180~200mAh/gとコバルト酸リチウムより少し大きいですが、充電状態での熱安定性や充放電サイクル特性は低下します。
充電状態での構造安定性を増大させるため、異元素で置換したLiCo1-x MnxO2、LiCo1-xNixO2、LiNi1-x MnxO2、LiNixCoyMn1-x-yO2(三元系、NMC)など各種化合物が検討されています。
この中では、電池容量と充放電サイクル特性などとの性能バランス、製造コストの点から三元系の正極活物質が実用化されています(HEV、PHEV)。
ニッケル原子の一部をAlおよびCoで置換したLiNi2-x-yCoxAlyO2でも、熱安定性およびサイクル特性が改善(可逆容量はニッケル酸リチウムと同程度)されます。
2.スピネル型複合酸化物系正極活物質(マンガン酸リチウム)
スピネル型複合酸化物であるマンガン酸リチウムLiMn2O4も、充放電に伴いリチウムイオンが脱離挿入します。
負極活物質をグラファイトとした電池では、以下の電気化学反応により、コバルト酸リチウムと同程度の約3.9Vの起電力が得られます。理論電池容量は148 mAh/gで、可逆容量は110~120mAh/gです。
Mn2O4 + LiC6 → LiMn2O4 + C6 E0=3.90V (5)
マンガン酸リチウムを用いた場合のメリットとデメリット
マンガン酸リチウムの長所は、マンガンがコバルト酸リチウムなどの層状化合物と比較して熱安定性が向上し(熱分解開始温度:LiNiO2<LiCoO2<LiMn2O4)、電池の安全性が向上する点です。
コバルトやニッケルと比較してマンガンは豊富に存在し、安価(コバルトの約1/10、ニッケルの約1/5)な点も大きな長所です。
一方、短所は充放電サイクル特性が悪い点です。
これは、充放電において生じるマンガン酸リチウムの相変化に伴い体積が膨張収縮すること、およびMn-O結合がCo-O結合やNi-O結合と比較して弱いためです。
Mnの一部をCo、Cr、Alなどで置換する方法、および/あるいは過剰のリチウム(Li1+xMn2-xO4)とすることにより、膨張収縮が緩和され、サイクル特性が改善します。
もうひとつの短所は、マンガン酸リチウム電池を高温(45℃以上)で保存すると、Mnが電解液に溶出し劣化する点です。高温でのサイクル特性を悪化させます。
マンガン酸リチウム粒子のコーティングや電解液の改良により、ある程度、改善が図られています。
短所を改善したスピネル型複合酸化物は、HEVやPHEVなどで実用化されています。
次回は続きとして、ポリアニオン系とリチウム過剰系の正極活物質についてご紹介します。
(日本アイアール株式会社 特許調査部 Y・W)












































