3分でわかる技術の超キホン 遷移金属の電子配置と性質
遷移金属に関する前回の記事「3分でわかる技術の超キホン 遷移金属の基礎知識」では遷移金属の分類についてご紹介しました。
今回は、遷移金属の電子配置について解説します。
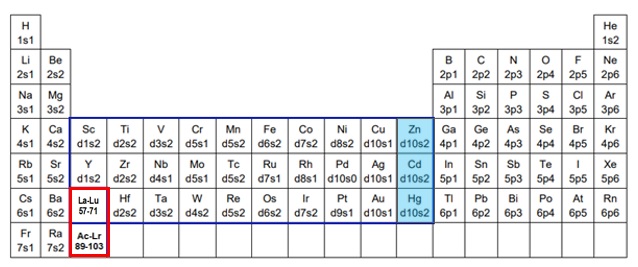
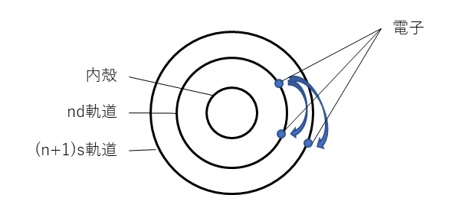
【図1 遷移元素の外殻電子配置】
1.物理性質・電子配置
前回の記事「3分でわかる技術の超キホン 遷移金属の基礎知識」の中で、遷移金属のd軌道やf軌道には空きがあったまま、s軌道やd軌道に先に電子が充填していく傾向があることをご説明しました(図1)。これは系全体のエネルギーの安定化のためです。
原子の電子配置は、軌道エネルギーのみで決まるわけではなく、電子間の反発を含める系全体のエネルギーによって決まるのです。これを影響する主な要因は、以下の二つがあります。
- ① 軌道エネルギー
- ② 電子間の静電気的な反発
実は、遷移金属においては nd(f) 軌道のエネルギーは (n+1)s 軌道よりも低いのです。
1s→2s→2p→3s→3p→4s→3d→4p の電子配置の規則に影響しているのは、主に②電子間の静電気的な反発によるものです。
主量子数が小さいため、3d(4f)軌道は、 4s(5s)軌道よりもコンパクトであると考えられます。軌道に収容された電子同士の平均距離も、同じ軌道の電子の平均的な距離より小さく、静電気的な反発が大きいです。
その結果、たとえ3d軌道より4s軌道のエネルギーが高かったとしても、4s軌道に電子が入る方が電子間反発を減らし、系全体として安定になれる可能性があるのです(図2)。
軌道のエネルギーによる電子配置が決まる例もあれば、このような電子反発の効果によって、3d遷移金属元素は4s軌道が先に占有される例もあります。軌道エネルギー変化が複雑で、これも遷移金属の様々な特異な性質を作り上げています。
【図2 電子間反発のイメージ図】
2.遷移金属と原子価
遷移金属の原子の電子配置を考えるときには、nd(f)軌道よりも(n+1)s 軌道の方が先に占領されるほうが安定で、原子番号が増えるにつれて、d(f)電子が一個ずつ増えていきますが、イオン化する時はどうなるのでしょうか?
軌道エネルギーは複雑であり、イオン化する時のエネルギー準位は原子形成する時と異なり、充填されたものと空の区別があります。傾向から言うと、 実は(n+1)s 軌道の電子を失いやすいです。その原因は軌道の分布にあります。s軌道の電子は原子核近くに電子密度分布があり、イオン化する時に(n+1)s 軌道の電子が先に抜かれると、nd(f)軌道の電子が原子核近くに電子密度分布を取りやすくなるため、位置エネルギーが低くなるからです。
そのため遷移元素では、族に関係なく二つのs電子を失い、2+の酸化状態をとりやすいです。
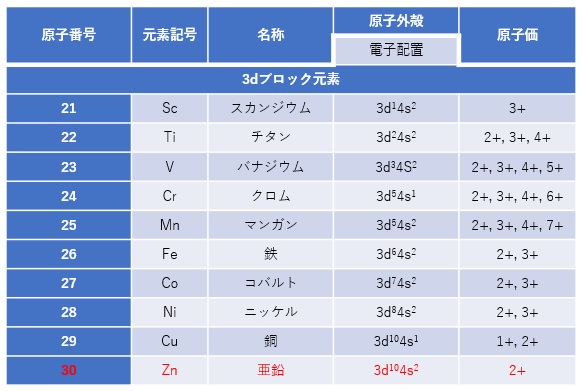
例えば、第10族3d金属であるNi(ニッケル)の中性真空下での電子配置は3d84s2で、2+陽イオンの真空下で電子配置は3d8となります。2+以外の原子価もみられます。最大で7まであります(表1)。
【表1 3dブロック元素の電子配置と原子価】
では1+イオンの電子配置はどうなるでしょうか?
3dブロックの第5族金属であるV(バナジウム)を見てみましょう。
中性真空下の基底状態の電子配置は3d34s2です。
電子1つを取り除いた陽イオンV+の真空下の基底状態の電子配置は、3d34s1ではなく、3d4です。
つまり、s軌道電子の一つを抜かれ、もう一つはd軌道に移動し、混成軌道のような3d4の方が、系全体は一番安定になります(図3)。
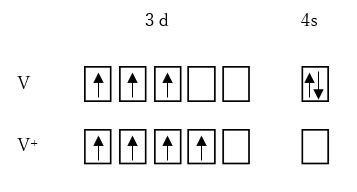
【図3 V原子とⅠ価陽イオンの電子配置】
3.遷移金属とイオン半径
遷移金属が酸化して同じ酸化数のイオンになると、有効核電荷が増加するため、共有結合半径は左から右に向かって短くなります。
また、周期表の縦を見てみると、同族の遷移金属イオン半径では、第二遷移系列(4d遷移元素)と第一遷移系列(3d遷移元素)は典型金属と同じ傾向で、[第一遷移系列(3d遷移元素)< 第二遷移系列(4d遷移元素)] となります。しかし、第三遷移系列(5d, 4f遷移元素)はランタノイドを含むため、ランタノイド収縮によって、第二遷移系列(4d遷移元素)と第三遷移系列(5d, 4f遷移元素)の半径はほぼ同じとなります。
遷移元素はd軌道またはf軌道など内殻に空位の軌道を有するため、内殻のd軌道に安定な不対電子を持つことが可能であり、遷移金属の多くは常磁性で複数の酸化数をとることが容易です。そして、d軌道はさまざまな配位子と結合して、同じ元素でも多様な錯体を形成できます。
(有機金属錯体及び結合様式については、別のコラムでとりあげる予定です。)
以上、今回は遷移金属の電子配置と性質についてご紹介しました。
(日本アイアール株式会社 特許調査部 H・L)