超分子とは何か?基本原理と自己組織化の代表例をやさしく解説

私たちの身の回りには、原子が共有結合でつながってできた分子があふれています。しかし、共有結合による結びつきではなく、非共有結合の弱い分子間相互作用によって分子同士が自発的に集まり、安定な構造体を形成して特異な機能を示す場合があります。こうした構造体を「超分子」(supramolecular)と呼び、その集合過程を「自己組織化」といいます。
超分子研究の発展は広範囲の分野に影響を与えています。例えば、生体内の複雑な構造や機能を理解して、人工的に模倣し、応用する道を開くものとして、薬学、材料学、ナノテクノロジーなどがあります。
目次
1.超分子とは?
「超分子」とは、複数の分子が水素結合、π-π相互作用、静電相互作用、疎水性相互作用、金属錯体形成などの非共有結合によって集合して、一つのまとまりある構造体を形成したものを指します。
2.超分子研究の歴史
超分子化学における先駆的な業績が認められ、1987年に以下3名の化学者がノーベル化学賞を授与されました。
- Charles John Pedersen:「有機の王冠」クラウンエーテル(crown ether)化合物の発見と、イオンや特定の金属原子を認識して、選択的に結合できる二次元の分子の合成に成功しました。
- Jean-Marie Lehn:クリプタンド(cryptand)化合物の発見と超分子の概念を提唱しました。
- Donald James Cram:ホスト–ゲスト化学の先駆者。様々な分子を選択して取り込みうる一連の3次元超分子を設計し、人工酵素などの開発へと繋がりました。
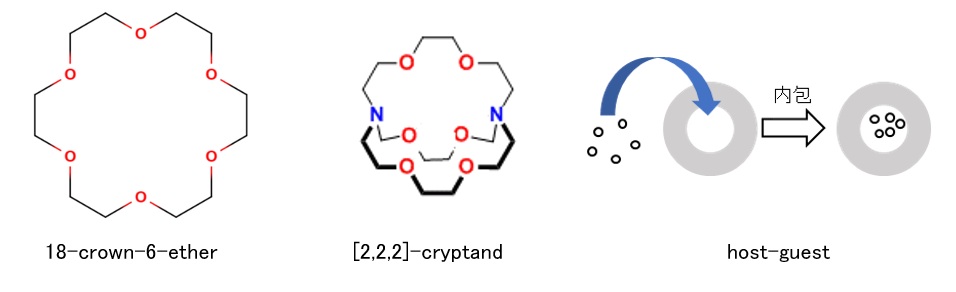
[図1.クラウンエーテル、クリプタンド類化合物の例]
3.超分子研究の主要な成果
(1)クラウンエーテルとクリプタンド
クラウンエーテル(crown ether)及びその後のクリプタンド(cryptand)類化合物には「ポケット」のような空間ができ、内側の酸素原子上の孤立電子対が、サイズの合った金属カチオンと錯形成して安定な錯体を形成します。
例えば、通常は有機溶媒に溶けにくい金属塩でも、適合サイズのクラウンエーテルや、より立体的なクリプタンドが存在すると、金属カチオンが捕捉され、多くの有機溶媒に溶けるようになります。
(2)ホスト–ゲスト(host-guest)化学
空間のサイズによって、ポケットに内包できる分子(イオン)が限られるため、相手の分子の「情報」を認識できることにより「ホスト–ゲスト化学」が確立されます。
これらの性質を利用することで、触媒を使う有機合成やイオン分離などの場面に応用することができます。
超分子の更なる研究による有名な開発例として、人工酵素やドラッグデリバリー・システム(DDS)等が挙げられます。
(3)自己組織化(self-organization)
超分子の形成において、カギとなるのは「自己組織化」(self-organization)です。これは一つ一つの分子が、自発的かつ選択的に秩序のある素晴らしい構造を形成する現象といいます。生物界ではこの現象は多く見られます。
例えば、細胞膜のリン脂質二重層やタンパク質のフォールディング、DNAの二重らせん構造などは、機能を果たすために極めて精緻な配置をとり、エネルギー的にも安定しています。まさに「分子世界の美術品」と呼べるでしょう。
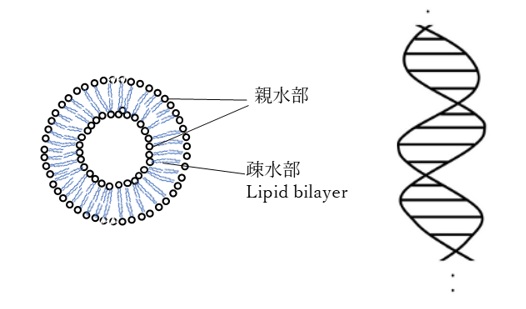
[図2.自己組織化によって形成される超分子の例:リン脂質二重層とDNAの二重らせん構造]
4.主な自己組織化の相互作用
普通の有機化合物は強い共有結合でできていますが、超分子の空間構成に関わる力は、金属配位結合、静電荷作用、水素結合、π-πスタッキングと疎水性作用などの弱い分子間相互作用です。
主な自己組織化の例として、以下のものが挙げられます。
(1)静電的相互作用
「静電的相互作用」とは、電荷や双極子の偏りによって生じる分子間の相互作用を指します。
(2)ファンデアワールス相互作用
「ファンデアワールス相互作用」は、中性分子や原子間に働く引力で、共有結合に比べてかなり弱いものの、分子サイズや接触面積が大きいほど寄与が増大します。
(3)金属配位結合
「金属配位結合」は、金属イオンと配位子の配位によって生じる比較的強い結合です。自己組織化の有力な方法の一つです。
遷移金属(d軌道)を用いると結合に方向性が生じるため、分子設計により幾何学的に整った超分子組成体を構築できます。さらに、遷移金属に特有の電子・光・磁気特性を示す可能性があり、分子エレクトロニクス材料への応用が見込まれます。
(4)水素結合
X-H…Y(X,Y=N, O, S, F, Cl等):電気陰性度の高い原子に結合した水素は部分正電荷を帯び、近傍の孤立電子対をもつ原子に引かれて水素結合を形成します。
例えば、DNAの二重らせんは、水素結合とπ-πスタッキングにより安定化します。
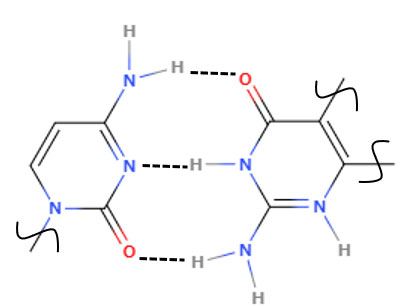
[図3.分子間水素結合による自己組織化]
(5)芳香環スタッキング
芳香族化合物は堅固な平面構造を有するため、面と面が重なるface-to-face型と、構造と交互に積み重なるherringbone型がよく見られます。
いずれも、π-πスタッキング相互作用が大きく寄与します。
① Face-to-face型
芳香環同士が平行に重なり合い、π電子雲が重なって安定化する配置です。
② herringbone型
芳香環がV字型またはジグザグに斜め配置し、主にC–H…π相互作用が働く配置です。
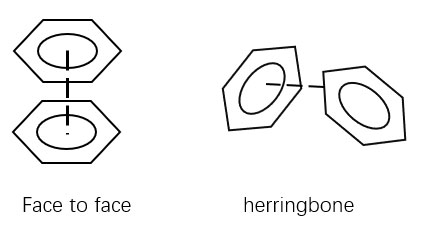
[図4.face-to-face型とherringbone型]
(6)疎水性相互作用
ひも状の有機分子の片側には疎水性と親水性部分がそれぞれ導入され、両親媒性分子となります。
これらの分子は水の中で自ら集まり、疎水部が内側、親水部が外側となった球状の構造になり、ミセル(界面活性剤分子が水中で球状に集合した構造)が形成されます。
油性の汚れをミセルの内側に内包して洗浄力を高めるといった界面活性剤への応用などが多く見られます。
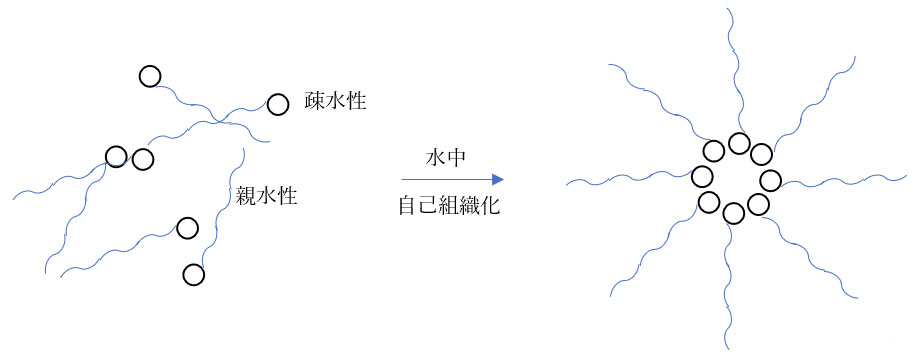
[図5.疎水性相互作用を駆動力とする自己組織化]
以上、今回は「超分子」の基礎知識を簡単にご紹介しました。
相互作用は複数を組み合わせることで、超分子構造を実現できる場合が多くあります。また、分子設計による微調整やコントロールも可能であり、新たな超分子開発における有力な手段となります。
(日本アイアール株式会社 特許調査部 H・L)
【関連記事】
・自己組織化って何ができる?[DDS/人工酵素/分子デバイス]はこちら