メッキの種類と原理|電気メッキ/置換メッキ/還元メッキの酸化・還元反応などを解説

様々な表面処理技術の中でも、メッキは古くから広く使用されている方法です。
今回は、メッキの大まかな分類をご紹介するとともに、「湿式メッキ」の種類である「電気メッキ」「置換メッキ」「還元メッキ」の原理(仕組み)について説明します。
目次
1.メッキとは?
「メッキ」(鍍金、めっき)とは、素材(処理品)に金属皮膜を析出させる表面処理のことです。
メッキは「湿式成膜法」と呼ばれ、金属イオンが溶け込んだ水溶液から、酸化・還元反応により金属を析出させて皮膜を形成する方法です。
この水溶液中では、酸化反応*で電子が放出され、還元反応*によりメッキとなる金属イオンが電子を受取り、素材に金属が析出し金属皮膜をつけることができます。
- 酸化反応:電子(ne–)の放出
- 還元反応:金属イオン(Mn+)が電子(ne–)を受け取る → 金属が析出
メッキの原理を説明する前に、酸化・還元の一般常識を確認しておきます。
一般的に、原子(またはその原子を含む物質)が電子を失う(放出する)変化を「酸化」といい、逆に、原子(またはその原子を含む物質)が電子を受け取る変化を「還元」といいます。
還元反応を起こすために、酸化反応で電子(ne–)を放出する必要がありますが、電子(ne–)の供給源により以下の3つに分類することができます。
- 電気メッキ(電気エネルギーでメッキ):電解メッキ
- 置換メッキ(イオン化傾向の大きさの違いよる化学反応でメッキ):無電解メッキ
- 還元メッキ(還元剤による化学反応でメッキ):無電解メッキ
[参考]メッキの分類について
なお、メッキの分類方法については様々な考え方があるようですが、ここでは薄膜成形技術としての大まかな分類例と代表的な種類をご紹介します。
【表1 メッキの分類例】
| 薄膜成形技術 | 特徴 | ||
| 湿式成膜法 (メッキ) |
水溶液中で成膜処理 | 電解メッキ (電気メッキ) |
電気エネルギーによりメッキする方法 |
| 無電解メッキ (化学メッキ) |
化学反応によりメッキする方法 [置換メッキ、還元メッキ] |
||
| 乾式成膜法 | 真空又は気体中で成膜処理 | PVD法 (物理蒸着) |
装置内で、膜材料を含んだ固体材料を物理的な手法を用いて蒸発・飛散させ、その粒子を対象物(基板など)に付着させる方法 |
| CVD法 (化学蒸着) |
装置内に膜材料を含んだガスを導入し、熱など外部からエネルギーを与えることより、ガス同士が化学反応を起こすことで、ガスの粒子を対象物(基板など)に付着させる方法 | ||
2.電気メッキ(電解メッキ)とは
電気エネルギーで反応を進める方式を「電気メッキ」(電解メッキ)と呼びます。
電気メッキでは電子(ne–)の供給源は外部電源の電気エネルギーです。
電気メッキの原理
例として、電気メッキにより、鉄に銅メッキする場合で説明します。
電気メッキは、メッキしたい金属イオン(図1の例ではCu2+)を含む水溶液中で、鉄のように導電性の処理品を陰極(-極)とし、メッキしたい金属(銅メッキしたい場合は銅)を陽極(+極)として電気分解するもので、以下のように酸化・還元反応が起こります。
酸化反応(陽極側):Cu → Cu2+ + 2e–
陽極側では酸化反応が起こり、陽極の金属が水溶液中に溶解し金属イオンCu2+となり、電子が放出し陰極側へ移動します。
このように、メッキしたい金属を陽極にする場合を「可溶性電極」と呼び、これによって減少した水溶液中の金属イオンを補給することができます。
これに対して、メッキ液に溶解しない陽極も使用されています。
還元反応(陰極側):Cu2+ + 2e– → Cu
陰極側では還元反応が起こり、外部電源から電極(陰極)に電子を供給することによって、金属イオンをCuに還元する反応が起こり、素材(処理品)を銅メッキすることができます。
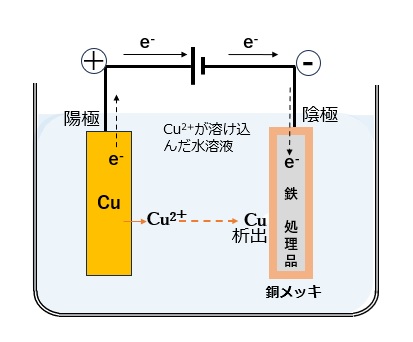
【図1 電気メッキのイメージ】
電気メッキの一般化モデル
電気メッキを一般化すると以下のようになります。
酸化反応(陽極側):金属(M)→金属イオン(Mn+) + 電子(ne–)
還元反応(陰極側):金属イオン(Mn+) + 電子(ne–) → 金属(M)
3.置換メッキとは
「置換メッキ」は、イオン化傾向の大きさの違いより、金属表面から電子(e-)が供給される方式です。
まずは一般知識としてイオン化傾向を確認しましょう。
(イオン化傾向大)Li>K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H) >Cu>Hg>Ag>Pt> Au (イオン化傾向小)
置換メッキの原理
例として、鉄を銅メッキする場合で説明すると、銅イオン(Cu2+)が溶け込んだ水溶液中に鉄(Fe)の素材を浸漬すると、FeがCuよりイオン化傾向が大きいので以下の酸化・還元反応が起きます。
酸化反応(鉄の溶解) : Fe → Fe2+ + 2e
鉄の表面では、イオン化傾向が大きい鉄表面から鉄が溶解し、鉄イオン(Fe2+)となり、電子を放出する酸化反応が起きます。
還元反応(銅の析出) : Cu2+ + 2e → Cu
水溶液中に存在するイオン化傾向の小さい銅イオン(Cu2+)が、イオン化傾向が大きい鉄表面から電子を受け取って銅金属として析出するという還元反応が起きます。
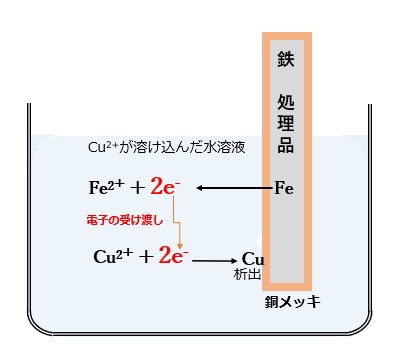
【図2 置換メッキのイメージ】
置換メッキの一般化モデル
置換メッキを一般化すると以下のようになります。
[イオン化傾向M1>M2]
酸化反応(M1金属の溶解): 金属(M1)→金属イオン(M1n+) + 電子(ne–)
還元反応(M2金属の析出): 金属イオン(M2n+) + 電子(ne–) → 金属(M2)
4.還元メッキとは
「還元メッキ」は、還元剤の酸化によって、電子(e-)が供給される方式で、メッキとなる金属イオンが電子を受取り金属皮膜が形成されます。
還元メッキの原理
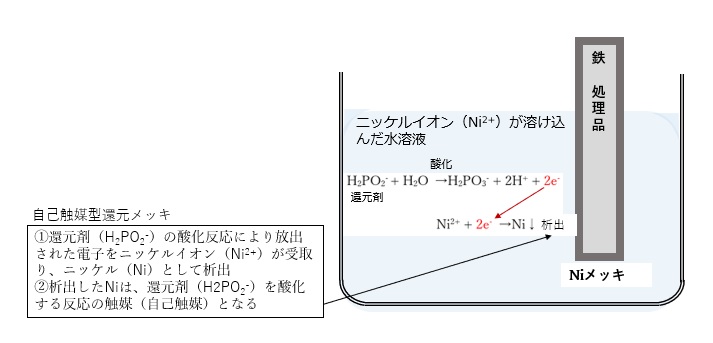
例として、鉄(処理品)をニッケルメッキする場合で説明します。
還元剤には、次亜リン酸ナトリウムなどの次亜リン酸を使用します。
まず、ニッケルイオン(Ni2+)が溶け込んだ水溶液に、鉄(処理品)を浸漬させます。
この水溶液に還元剤として次亜リン酸(H2PO2–)を加えます。
次亜リン酸による還元メッキの反応は以下です。
酸化反応:H2PO2– + H2O → H2PO3– + 2H+ + 2e–
(還元剤の次亜リン酸(H2PO2–)が亜リン酸(H2PO3–)に酸化)
還元反応:Ni2+ + 2e– → Ni
還元剤(H2PO2–)の酸化反応により放出された電子をニッケルイオン(Ni2+)が受取り、ニッケル(Ni)として析出しニッケルメッキを形成します。
なお、析出したNiは、還元剤(H2PO2–)を酸化する反応の触媒(自己触媒)となります。
継続的に、溶液中のニッケルイオンがなくなるまで反応できます。このような還元メッキを「自己触媒型還元メッキ」と呼びまず。
自己触媒型還元メッキは、メッキ厚を厚くできるメリットがあります。一方で、還元メッキの中には、自己触媒のない非触媒型還元メッキもありますが、金属イオンの消費が激しいため、厚いメッキは困難です。
【図3 還元メッキのイメージ】
還元メッキの一般化モデル
還元メッキを一般化すると以下のようになります。
なお、還元メッキは、電気の通電を行うことなく、素材(処理品)を水溶液に浸すことで素材の種類に関係することなくメッキができます。
そのため、電気を通さないプラスチックやセラミックのような素材にも金属皮膜を形成することが可能です。
酸化反応:還元剤(Red)+ H2O → 還元剤の酸化(Ox)+ 2H+ + 2e–
還元反応:M+ + e– → M
ということで今回は、メッキの種類(分類)と、電気メッキ・置換メッキ・還元メッキの概要と原理について解説しました。
次回は、塗装の基礎知識(原理・種類・特徴など)をご説明します。
(アイアール技術者教育研究所 T・I)
≪引用文献、参考文献≫
- 1)遠藤 豊春,「金属素材のめっき前処理」,表面技術 64巻12号
- 2)大野 湶, 若林 理, 春山 志郎, 「無電解めっきにおける次亜リン酸ナトリウムのアノード酸化に対する金属の触媒活性」, 金属表面技術/34 巻 (1983) 12号
- 3)逢坂 哲彌, 黒川 義昭,「薄膜と表面技術」,表面技術 45巻12号