真性高分子固体電解質とリチウムイオン電池

電解質を溶解してイオンに解離し、移動できる物質を「イオン伝導性物質」と呼びます。
また、イオンが溶解したイオン伝導性物質が常温常圧で固体の場合、固溶体などとして溶解し電気伝導性を示す物質を「固体電解質」と呼びます。
当連載では、これまでに [LiPF6/EC系][スルホンアミド系、イオン液体、水系] と2回にわたり、リチウムイオンの液体電解質について説明しました。
一方、固体のリチウムイオン伝導性物質としては、有機高分子系、無機系(酸化物、硫化物、ヒドリド錯体)が知られています。
今回は、主として有機高分子系イオン伝導性物質と電解質塩からなり、溶媒を全く含まない真性高分子固体電解質について説明します。
目次
1.結晶性/非晶性プラスチック、ガラス転移点と融点
有機高分子系イオン伝導性物質について説明する前に、プラスチック(樹脂)のガラス転移点、融点について説明します。
熱可塑性プラスチック(熱可塑性樹脂)は、固体での状態から結晶性プラスチックと非晶性プラスチックに分けることができます。
プラスチックは長い高分子鎖が集合して構成されています。
高分子鎖が規則正しく並んだ部分(結晶質セグメント)を持つ樹脂を「結晶性プラスチック」、結晶質セグメントを持たない樹脂を「非晶性プラスチック」と呼びます。
結晶性プラスチックは、結晶質セグメントと非晶質セグメント(高分子鎖がランダムに配列)からなり、非晶性プラスチックは非晶質セグメントのみからなります。
結晶性樹脂中の結晶質の比率(結晶化度)は樹脂の種類により異なります。
ゴム状態・ガラス状態
非晶性プラスチックや結晶化度が低い結晶性プラスチックは、温度によって、「ゴム弾性」を示します。
「ゴム弾性」とは、わずかな外力で変形し(弾性率が金属や無機ガラスの1~10万分の1)、容易に破断せず、力を除くと元の形状に戻る性質です。
ゴム弾性は、分子レベルでは、温度の上昇に伴い非晶質セグメントの高分子主鎖の回転運動が活発となり、より安定な丸まった形状をとろうとする(収縮する)ことにより説明されています。ゴムに重りを吊るして伸びた状態で加熱すると収縮します。細長く屈曲し易い有機高分子鎖に特有な弾性です。ゴム弾性を示す物質の状態を「ゴム状態」と呼びます。非晶質セグメントはゴム状態(高分子の相対的な位置は変化しないが、主鎖は回転や振動できる状態)にあると言います。
温度が下がるにつれて、熱可塑性樹脂を構成する高分子鎖は運動性を失っていきます。ある一定温度以下になると、非晶質セグメントは分子配列がランダムなままで凍結したような状態(ガラス状態;高分子の相対的な位置が変化せず、分子内の回転や振動を極端に低下した状態)になります。
熱可塑性樹脂において、ゴム状態からガラス状態(あるいはその逆)に転移する温度を「ガラス転移点(Tg)」と呼びます。
結晶性プラスチックでは、ガラス転移点を超えてさらに温度が上がると、結晶質セグメントでも、高分子鎖を規則正しく配列していた水素結合などの分子間結合が切断され、全てのセグメントで高分子鎖がランダムな配列になり流動性が生じます(融解)。この流動性が生じる温度が結晶性プラスチックの融点です(通常、いろいろな分子量の集合体なので低分子のような鋭い融点を示さないことも多く、「軟化点」と記載されることもあります)。
また、転移点は降温速度や昇温速度により変化します。
大まかには、結晶性プラスチックでは、低温から高温に向かって[ガラス状態→ゴム状態→液体]と転移し、各転移点がガラス転移点、融点です。
一方、非晶性プラスチックでは、低温から高温に向かって[ガラス状態→ゴム状態]に転移し、転移点はガラス転移点のみです。
2.真性(純正)高分子固体電解質とは?
「真性(純正)高分子固体電解質」とは、イオン伝導性有機高分子と電解質塩を基本成分とし、溶媒を全く含まない固体電解質です。
イオン伝導性を有する有機高分子であるためには、イオンに解離、固溶し易い極性基(エーテル、エステルなどの含酸素基、ハロゲン、シアノ基など)を有すること、およびイオンが移動し易いために低ガラス転移点であることが必要です。
アルカリ金属イオン伝導性有機高分子「ポリエチレンオキシド」(PEO)
リチウムなどアルカリ金属イオン伝導性有機高分子の代表例は、ポリエチレンオキシド(PEO;(CH2CH2O)n;分子量は数万以上)です。軟化点が65~67℃、ガラス転移点が-60~-70℃の結晶性プラスチックです。
大きな双極子モーメントを持つPEO鎖の酸素原子がリチウムイオンに配位することにより、リチウム塩が解離して固溶体として溶解します。
ガラス転移点が低いため、室温でもPEO鎖(非晶質セグメント)の熱運動に伴って、隣接する酸素原子による共同的なイオン-双極子相互作用によりリチウムイオンが移動します(図1)。
リチウムイオン濃度の増大に伴いイオン伝導度が上昇しますが、一定濃度を超えると急激な減少に転じます。リチウム塩の添加に伴いガラス転移点が上昇します。一定濃度を超えると、共同的な熱振動によるイオン移動より、リチウムイオン-双極子相互作用による固定化が優勢になるためと説明されています。
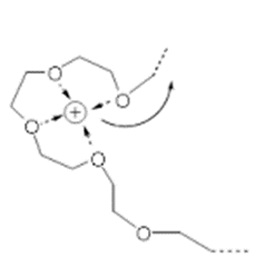
[図1]
また、PEO/リチウム塩型固体電解質におけるイオン伝導は、主にリチウム塩の対アニオンの移動によることが判明しています。これは、リチウムイオンの輸率が低いことを意味し、リチウムイオン二次電池の電解質としては好ましくありません。
PEO/リチウム塩型固体電解質を利用したリチウムイオン二次電池の利点は、引火や爆発の危険性が低いこと、漏液の心配がないこと、自由な形状に加工できること、軽いことなどです。
一方、課題はまだイオン伝導率が低い(10-4~10-3S/cm,室温 cf. 1M LiPF6/EC-DMCでは9~10mS/cm)こと、リチウムイオンの輸率が低い(0.2~0.4)ことです。
イオン伝導率の向上
イオン伝導率の向上については、ガラス転移点を低く保とうとするアプローチ(イオン-双極子相互作用を弱くするなどの高分子の設計、可塑剤の添加)、リチウムイオンをより移動し易くしようとするアプローチ(極性基を側鎖に導入した分岐型高分子など)などが検討されています。
検討された高分子(主鎖)は、ポリプロピレンオキシド、ポリ塩化(フッ化)ビニル(ビニリデン)、ポリ酢酸ビニル、ポリアクリル(メタクリル)酸エステル、ポリアクリル(メタクリル)酸アミド、ポリ-N-ビニルアセトアミド、ポリエチレン(プロピレン)カーボネート、ポリシロキサン、ポリホスファゼンなどであり、変性基はポリオキシエチレン基やシアノ基など多数にのぼります。この中では、ポリエチレン(プロピレン)カーボネートが比較的高いイオン伝導率(1~10mS/cm、室温)を与えます。
リチウム塩の種類およびイオン濃度により、イオン伝導率は影響を受けます。
スルホンアミド系リチウム塩であるリチウムビス(トリフルオロメタンスルホニル)アミドLi(CF3SO2)2Nやリチウムビス(フルオロスルホニル)アミドLi(FSO2)2Nではイオン伝導率が向上すること、ポリエチレン(プロピレン)カーボネート/ Li(FSO2)2N系では、イオン濃度の上昇とともにイオン伝導率が上昇するという従来とは異なる挙動を示すことが判明しています。
可塑剤としてエチレンカーボネートなどが、結晶化阻害剤としてアルミナなどの無機フィラーなどが検討され、イオン伝導率の改善が確認されています。
リチウムイオン輸率の向上
リチウムイオン輸率の向上については、リチウムイオンの対アニオンを高分子として固定する方法、高分子によりアニオンを捕捉する方法などが検討されています。
- リチウムイオンの対アニオンを高分子として固定するためには、PEOなど上記した高分子主鎖の末端にアニオン性基(カルボキシル基、スルホン酸基、スルホンアミド基など)を導入します。
- 高分子によりアニオンを捕捉するためには、ルイス酸性を示す電子欠損型の元素であるホウ素やアルミニウムなどを高分子に導入します。
いずれの方法も、リチウムイオン輸率が0.7以上、場合によっては0.9超に向上することが判明しています。
活発に研究が続けられていますが、まだ、真性高分子固体電解質を実用化したリチウムイオン二次電池はありません。
(日本アイアール株式会社 特許調査部 Y・W)











































