抗体医薬をアジアCDMOへ委託する際の注意点|必ず押さえるべき4つの重要ポイント

抗体医薬の製造には、設備や人材など多額の初期投資が必要です。そのため、研究開発を専門とする製薬企業やスタートアップが、自社で大規模な製造能力まで整えることは容易ではありません。
そこで、医薬品の製造工程開発、治験薬製造、商用生産などを受託製造するCDMO(Contract Development and Manufacturing Organization:開発・製造受託機関)を活用し、開発スピードを高める手法が広く採用されています。
アジアのCDMOは、コスト面での競争力や政府のバックアップなどにより実績を築いており、近年注目を集めています。一方で「欧米のCDMOに比べるとリスクがあるのではないか」と懸念する方もいるかもしれません。確かに注意すべき点はありますが、適切に対策を講じることでリスクは十分に低減できます。
本記事では、抗体医薬をアジアのCDMOへ委託する際に押さえたい注意点を解説します。
1.抗体医薬をアジアCDMOに委託する際の4つの注意点
今回取り上げる注意点は、以下の4つです。
- (1) 輸出管理
- (2) データインテグリティ
- (3) 秘密保持・知的財産
- (4) 日本での外国製造所登録
(1)輸出管理
「安全保障貿易管理」とも呼ばれ、大量破壊兵器などの開発に自社の製品・技術が利用されることを防ぐルールです。
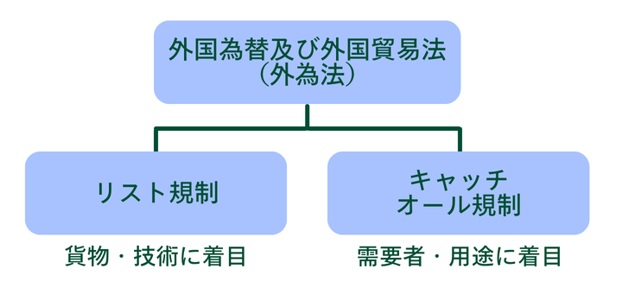
日本では「外国為替及び外国貿易法(外為法)」に従って、貨物の輸出・技術の提供が管理されています。CDMOへの委託に関連する行為も、規制の対象です。
この制度は、「リスト規制」と「キャッチオール規制」の二段構えで成り立っています。
【図1 外為法】
① リスト規制
「軍事転用される可能性が特に高い」と国が判断した品目を整理したリストと、輸出予定の貨物・技術情報を照合します。この作業は、「該非判定」と呼ばれています。リストに該当する場合は、原則として経済産業大臣の許可が必要です。
該当する可能性があるため確認が必要な品目の一例が、下表です。
経済産業省が提供する「貨物・技術のマトリクス表」を参照し、記載内容に該当するかを詳細に確認します。
以下のように、貨物だけでなく技術情報の提供も対象となる点は、見落としがちです。
例えば、自社の試作条件やデータをメールで送付する際も、該非判定を忘れないようにしましょう。
|
区分 |
例 |
| 貨物 | 自社から提供する細胞株、原材料 |
| 技術情報 | 自社の試作条件、試作品に関するデータ |
② キャッチオール規制
リスト規制を補完する目的で設けられているのが「キャッチオール規制」です。
リストに該当しない場合でも、需要者や用途に軍事利用のおそれがあると判断されれば経済産業大臣の許可を必要とします。
具体的には、以下2点について確認します。
|
要件 |
内容 |
| 需要者 | 過去に兵器の開発に関与した経歴がないか |
| 用途 | 提供する技術が兵器の開発に使われるおそれがないか |
輸出管理が厳格とされる「グループA」(旧ホワイト国)に属する国が輸出先であれば、許可申請は不要です。
グループAに属するのは、ヨーロッパの主要国やアメリカなど、以下の 27ヶ国です。
【グループAの27カ国】
アルゼンチン、オーストラリア、オーストリア、ベルギー、ブルガリア、カナダ、チェコ、デンマーク、フィンランド、フランス、ドイツ、ギリシャ、ハンガリー、アイルランド、イタリア、韓国、ルクセンブルク、オランダ、ニュージーランド、ノルウェー、ポーランド、ポルトガル、スペイン、スウェーデン、スイス、英国、アメリカ
アジアに目を向けると、韓国のみがグループAに属しています。
例えば、中国やシンガポールの企業に委託する際は、申請の要否検討が必要です。
もし規制に違反してしまった場合、以下の罰則が適用される可能性があります。
|
罰則 |
内容 |
| 刑事罰 | 10年以下の懲役、10億円以下の罰金 |
| 行政制裁 | 3年以内の貨物輸出・技術提供禁止、別会社の担当役員等への就任禁止 |
| 警告 | 違反企業に対する警告(原則公表) |
社内に輸出管理の体制を整え、手続きを丁寧に進めましょう。
例として、経済産業省が定める「輸出者等遵守基準」では、該非判定責任者の設置が義務付けられています。
輸出する貨物や技術に知見を有する必要があるため、技術部門から選ばれることが一般的です。
(2)データインテグリティ
製造や品質試験で得られるデータは、医薬品の品質と安全性を保証する根拠そのものです。
万が一、欠損や改ざんがあれば、患者に深刻な健康被害を及ぼすリスクが生じます。
そこで登場するのが、データインテグリティ(DI)の考え方です。
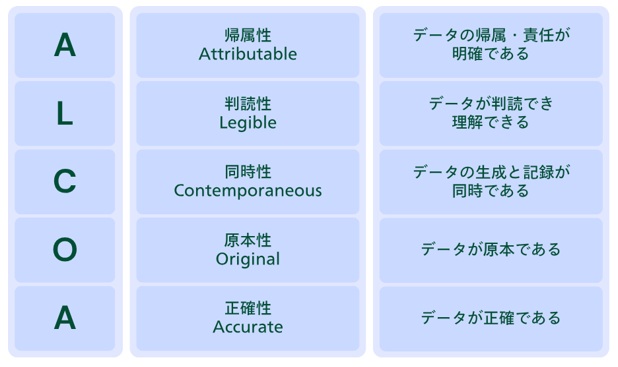
DIに関する国際的な原則としては、「ALCOA」が広く知られています。
ALCOAとは、データが満たすべき5つの要件[Attributable(帰属性)、Legible(判読性)、Contemporaneous(同時性)、Original(原本性)、Accurate(正確性)]の頭文字を取ったものです。
【図2 ALCOAの定義】
近年では、さらに4つの要件[Complete(完全性)、Consistent(一貫性)、Enduring(耐用性(永続性))、Available(可用性)]の頭文字を加えた「ALCOA-CCEA」という考え方が主流です。
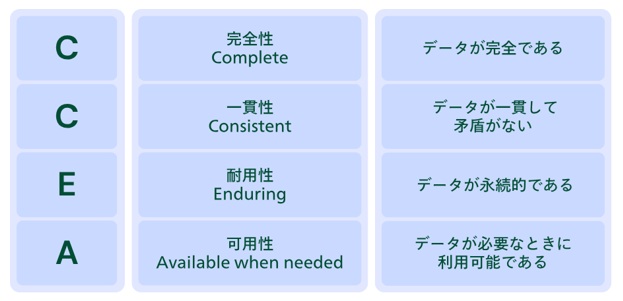
【図3 CCEAの定義】
FDA(米国食品医薬品局)は、2018年に「Data Integrity and Compliance With Drug CGMP」と題したガイダンスを発行しました。これにより、DIは重要な規制要件として位置付けられています。
仮に、委託するCDMOにDI遵守の文化が浸透していなければ、規制当局の監査に対応できないリスクが大きくなるでしょう。逸脱の例としては、以下のような事項が挙げられます。
|
事項 |
内容 |
| 試験結果の破棄 | 不合格となった試験結果を意図的に破棄し、合格となるまで再試験を繰り返す |
| 記録の不足 | 作業の直後にデータを記録せず、後からまとめて記入することで漏れが生じる |
| 生データの欠如 | 試験の生データを適切に保存せず、最終的な結果のみを記録する |
| 不適切なアクセス管理 | データの編集・削除が誰でも可能な状態にあり、変更履歴が残されていない |
CDMOを選ぶ際には、事前の調査でDIへの取り組みを評価しましょう。
(3)秘密保持・知的財産
抗体医薬の製造委託では、開発の根幹となる技術情報やノウハウをCDMOへ開示する必要があります。
適切な対策を怠ると、情報が漏洩したり、本来の目的以外で使われたりする危険性があります。
また、共同開発で生まれた新しい技術の権利帰属が曖昧になることも問題です。
そのようなリスクを防ぐため、「秘密保持契約」と「業務委託契約書」で以下について事前に規定しましょう。

【図4 「秘密保持契約」と「業務委託契約書」】
まず、本格的な交渉を始める前に秘密保持契約を締結します。
契約では、「秘密情報の範囲」「目的外使用の禁止」「契約終了後の秘密保持期間」などを明確に定めます。
これにより、機密情報に関するリスクを抑制できるでしょう。
次に作成するのが、業務委託契約書です。
ここでは、新たに生まれた発明・技術の権利がどちらに帰属するのかを明確に定めましょう。
(4)日本での外国製造所登録
開発した医薬品を日本に展開したい場合は、「外国製造所登録」にも注意しましょう。
日本で治験・販売を行う医薬品を製造する海外事業者は、厚生労働大臣から「外国製造業者」の認定を受ける必要があります。
仮に、PMDA(医薬品医療機器総合機構)が求める要求水準をCDMOが理解していない場合、品質管理体制が不十分となるかもしれません。その結果、審査で多くの指摘を受けて改善に時間がかかり、認定が遅れてしまうリスクがあります。
また、認定は5年ごとの更新が必要です。更新が期限に間に合わない場合、認定が失効し、当該製造所からの供給が停止します。2016年の厚生労働省の通知によると、更新申請が遅れた結果、認定の有効期限に手続き完了が間に合わない事例が頻発したと報告されています。
委託先のCDMOを選ぶ段階では、日本向けの医薬品製造実績や、PMDAの査察をクリアした経験があるかを確認しましょう。
2.まとめ
本記事では、抗体医薬をアジアCDMOに委託する際の注意点について解説しました。
取り上げた注意点は、以下の4つです。
- (1) 輸出管理
- (2) データインテグリティ
- (3) 秘密保持・知的財産
- (4) 日本での外国製造所登録
CDMOの活用は、今や抗体医薬の開発に欠かせないものとなっています。
その上で、コスト優位性のあるアジアCDMOをうまく活用できれば、開発コストを抑えられます。
ここまで解説した内容を参考に、想定されるリスクを極力減らしながら委託を進めましょう。
本記事では概要の説明に留まりましたので、より詳しい知識を習得したい場合は、専門セミナーの受講をおすすめします。
当サイトでも抗体医薬に関するセミナーを紹介していますので、ぜひチェックしてみてください。
(アイアール技術者教育研究所 YHR)