≪ICH Q3Dと第十八改定日本薬局方に基づいた≫医薬品中の元素不純物のデータ及びPMDA等への対応の重要ポイント(情報機構)【提携セミナー】
おすすめのセミナー情報
| 開催日時 | 2023/2/21(火) 13:00-16:30 |
|---|---|
| 担当講師 | 宮木 晃 氏 |
| 開催場所 | Zoomによるオンラインセミナー |
| 定員 | - |
| 受講費 | 【オンラインセミナー(見逃し視聴なし)】:41,800円 【オンラインセミナー(見逃し視聴あり)】:47,300円 |
☆第十八改正日本薬局方(日局/JP18)が施行され、実施せざるを得なくなった
“ICH Q3Dを踏まえた元素不純物の管理対応”。ガイドラインの重要ポイントを整理してお伝えします
☆元素不純物の管理と製剤・原薬・添加剤等のリスクアセスメント(リスク管理)及び
ICHQ3Dの重要性さらにPMDAへの製造販売申請と当局(PMDA等)によるGMP査察対応方法まで!
≪ICH Q3Dと第十八改定日本薬局方に基づいた≫
医薬品中の元素不純物のデータ及び
PMDA等への対応の重要ポイント
≪PMDAでの製造販売承認書の審査と医薬品製造所のGMP査察における対処方法≫
【提携セミナー】
主催:株式会社情報機構
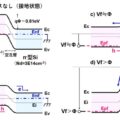
ICH Q3D(医薬品の元素不純物ガイドライン/平成27年9月30日厚生労働省審査管理課)は2015年4月1日以降に承認申請された新製剤が適用対象とされてきた。ICH Q3D(R1)、第十七改正日本薬局方第二追補等を経て、2021年6月7日に第十八改正日本薬局方(日局/JP18)に元素不純物として明記されることが告示・施行された。
告示施行後、日局製剤及び局外品も36か月までのガイドライン通知及びJP18の規定に基づく、ICH Q3Dを踏まえた元素不純物の管理に対応することが求められることとなり、3年が経過するまでにICH Q3Dに基づく対応を終了しなければならない。
製薬会社は原薬も含めて研究開発の段階から生産の段階さらに新医薬品及びジェネリック医薬品を含めた上市品まで、ICH Q3Dを踏まえたJP18による管理規定をどのようにして運用・構築を図るかが今後の課題である。
本講座では、医薬品中の元素不純物の管理と製剤・原薬・添加剤等のリスクアセスメント(リスク管理)及びICH Q3Dの重要性さらにPMDAへの製造販売申請と当局(PMDA等)によるGMP査察対応方法について説明する。
◆受講後、習得できること
1) ICH Q3Dガイドラインの重要点を理解できる。
2) 第十八改正日本薬局方(JP18)で求めている重要事項を把握できる。
3) 医薬品製造販売承認申請の対応点を把握できる。
4)製造所で当局(PMDA等)によるGMP査察の対処法を把握できる。
◆講演中のキーワード
- ICHQ3D
- リスクアセスメント
- JP
- ICP-MS/AES/OES
- PMDA
◆本テーマ関連法規・ガイドラインなど
- ICH Q3D(医薬品の元素不純物ガイドライン)
- JP18(2.66 元素不純物ガイドライン
担当講師
SANSHO(株) サイエンスアドバイザー/元PMDA GMPエキスパート 宮木晃 先生
■主経歴
アステラス製薬(株)、ノバルティスファーマ(株)、キリンビール(株)医薬開発研究所/高崎医薬工場、独立行政法人医薬品医療機器総合機構(PMDA)、上武大学看護学部専任講師、高崎健康福祉大学 TRセンター長(代表理事)(~2016.7)
■本テーマに関する業界団体活動
製剤機械技術学会 監事(2011.10~2017.6)
■専門分野・研究
・国内・海外製造所の医薬品GMPの調査・査察業務
・再生医療等製品の研究開発及びGCTP省令に基づく施設の建設・監査等の業務
・製剤処方設計の研究(主に固形製剤、注射剤)
・製造販売承認申請のCMC業務
・医薬品製造所の医薬品・生物由来製品の品質保証業務(製造管理者業務)
・治験薬の製造管理・品質管理業務
・医薬品元素不純物(ICH Q3D)の分析に係わるPMDA等への対応業務
セミナープログラム(予定)
1. 本講座の狙い
2. ICHQ3Dから元素不純物 (日局18 2.66)までの変遷
3. 医薬品製造承認販売申請からGMP適合性調査申請への流れ
4. GMPの規制要件とガイドラインについて
5. 医薬品の元素不純物ガイドライン(ICHQ3D/ 平成27年9月30日)の趣旨
6. 第十七改正日本薬局方第二追補(平成元年 6月28日/厚労省告示)の内容について
7. 第十八改正日本薬局方(JP18)での内容について
8. 第十八改正日本薬局方(JP18)で求めている重要事項は?
9.医薬品製造販売承認申請の留意点は?
10. 元素不純物試験の評価手順
11. リスクアセスメント(リスク管理)の進め方は?
1) 品質リスクアセスメントとは?
2) 製剤メーカー又は製造販売業者の対応は?
3) 原薬メーカー又は輸入業者の対応は?
4) 添加剤メーカーの対応は?
12. 元素不純物のリスクアセスメントは?
1) 品質リスクマネジメント(ICHQ9)とは?
2) 品質リスクマネジメントの実施状況
3) 改定GMP省令における品質リスクマネジメントの重要性
13.医薬品品質システムガイドライン(ICHQ10)の内容
1) 医薬品品質システムとは?
2) 第十八改正日本薬局方(JP18)の8ライフサイクルマネジメントとの関連性
14.分析体制をどうするか?
1) 自社で分析?
2) 委託分析?
3)分析機関は?
15.PMDAによる審査及び製造所のGMP実地調査(査察)対応は?
1) 製造販売業との情報共有は?
2) サイトQAの役割と責任は?
3) 製造業の更新時における調査(査察)の対処法は?
4) 指摘事項の対する回答法は?
16.製薬会社(新薬開発型、ジェネリック型)の今後の方向性は?
17.よくある質問事項は?
18.PMDA医薬品品質管理部の動向及び相談
<質疑&応答>
公開セミナーの次回開催予定
開催日
2023年2月21日(火) 13:00-16:30
開催場所
Zoomによるオンラインセミナー
受講料
【オンラインセミナー(見逃し視聴なし)】:1名41,800円(税込、資料付)
*1社2名以上同時申込の場合、1名につき30,800円
【オンラインセミナー(見逃し視聴あり)】:1名47,300円(税込、資料付)
*1社2名以上同時申込の場合、1名につき36,300円
*学校法人割引;学生、教員のご参加は受講料50%割引。
●録音・録画行為は固くお断り致します。
備考
配布資料・講師への質問等について
●配布資料はPDF等のデータで送付予定です。受取方法はメールでご案内致します。
(開催1週前~前日までには送付致します)。
*準備の都合上、開催1営業日前の12:00までにお申し込みをお願い致します。
(土、日、祝日は営業日としてカウント致しません。)
●当日、可能な範囲で質疑応答も対応致します。
(全ての質問にお答えできない可能性もございますので、予めご容赦ください。)
●本講座で使用する資料や配信動画は著作物であり
無断での録音・録画・複写・転載・配布・上映・販売等を禁止致します。
お申し込み方法
★下のセミナー参加申込ボタンより、必要事項をご記入の上お申し込みください。
★【オンラインセミナー(見逃し視聴なし)】、【オンラインセミナー(見逃し視聴あり)】のいずれかから、ご希望される受講形態をメッセージ欄に明記してください。