3分でわかる技術の超キホン イムノアッセイとは

「イムノアッセイ」については、医学、薬学、その他生物系の勉強をされた方の多くは、おそらくその基本原理をご存知のことと思います。
今回のコラムでは、そのような方は基本知識の復習として、その他の分野の皆様にはできるだけ分かりやすく、イムノアッセイについてご説明したいと思います。
目次
1.「イムノアッセイ」とは?
「イムノアッセイ」(「Immuno」=免疫、「Assay」=測定法)は、免疫測定法(免疫学的測定法)ともいわれます。ひとことで言うと「免疫反応を利用して,微量物質の検出・定量を行う生化学的手法」です。
通常、測定すべき微量物質(ホルモン、酵素、細胞表面抗原など)を抗原とする抗体を作成し、抗原抗体反応の高い特異性を利用した、微量物質の測定法(分析法)と定義できます。
2.標識イムノアッセイと非標識イムノアッセイ
抗原抗体反応を検出するために、目印(「標識」と言います)を使用する方法と、標識を使用しない方法に大別されます。前者を「標識イムノアッセイ」、後者を「非標識イムノアッセイ」と呼ぶこともあります。
(1)非標識イムノアッセイの種類とその限界
歴史的には、非標識イムノアッセイは古くから行われていました。
抗体価の測定法として抗体と抗原の溶液の界面における沈降反応を利用した方法や、寒天板での拡散沈降反応(オクタロニー・テスト)、半定量的には赤血球凝集反応や、ラテックス凝集反応、補体結合反応、免疫比濁法などです。これらの非標識イムノアッセイは、簡便ですが、高感度化には限界がありました。
なお、通常の比濁法と比べると高感度な方法として、レーザーイムノアッセイが開発されています。これは、免疫反応で形成された抗原抗体複合体に、レーザー光線を当て、散乱の度合いによって、抗原または抗体を測定する方法です。
(2)標識イムノアッセイの歴史と主な種類
1956年にS. A. Berson とR. S. Yalow(インスリンに対するRIA法の開発により1977年度ノーベル生理学医学賞)よって発表されたラジオイムノアッセイ(Radioimmunoassay, RIA)が定量性を特徴とする最初の標識イムノアッセイです。RIAの標識物質としては、放射性ヨウ素(125I)、トリチウム(3H)などの放射性同位元素(Radioisotope、RI)が使用されます。
放射性同位元素を使うため、放射性廃棄物が出ることや、施設の整備、比較的高価な測定装置といった問題があり、RIAを大規模に応用できた組織は限られていました。
その後、1971年に酵素を標識として使用するエンザイムイムノアッセイ(酵素免疫測定法;EIAまたはELISA(Enzyme-Linked ImmunoSorbent Assay))が開発され、RIAと比べて、放射性物質を用いないため安全性が高く、安価で簡便であるため、現在盛んに用いられています。
EIAの標識物質としてはペルオキシダーゼ、ガラクトシダーゼ、β-グルクロニダーゼなどが使用されます。
ちなみに、抗原、ハプテン(免疫原性を欠き、反応原性のみをもつ抗原。脂質や核酸などの分子量数百以下の低分子。)あるいは抗体を不溶化した固相を用いるEIAを、「ELISA」と呼ぶこともあるようです。
標識イムノアッセイとしては、RIA、EIA以外にも以下のような方法が利用されています。
- 蛍光イムノアッセイ(FIA)
- 蛍光偏光イムノアッセイ(FPIA)
- 化学発光イムノアッセイ(CLIA)
- 金属イムノアッセイ
- スピンイムノアッセイ
以上は標識、非標識による分類ですが、イムノアッセイは以下のような分類もされます。
3.測定原理による分類
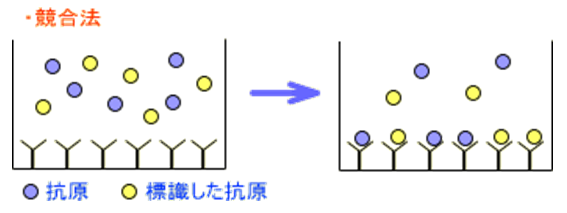
(1)競合的結合原理によるもの(Competitive assays)
一定量(少量)の抗体に対して標識物質と非標識物質とが競合的に結合することを利用して測定します。
反応系に標識抗原のみを加えれば抗体に結合する物は、すべて標識抗原です。
これに非標識抗原を加えると、その量に応じて抗体と結合する標識抗原の量は減少していきます。
結合および遊離の標識抗原を分離し定量することで、加えた非ラベル抗原の量が求められます。
分離法としては、二次抗体、つまり最初の抗体に対する抗体を用いて沈澱させ遠心分離する方法や、活性炭やメンブランフィルターで抗体を吸着する方法があります。
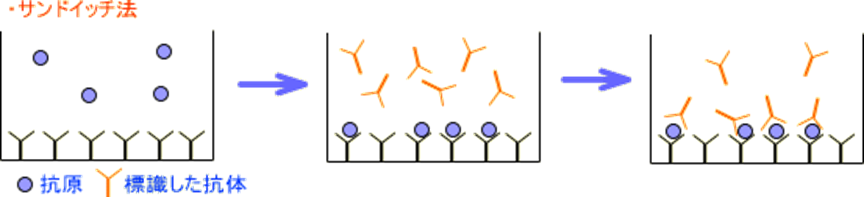
(2)非競合的結合によるもの(Non-competitive assays)
固相化した充分量のキャプチャー抗体で測定対象物質を捉え、それを標識した抗体で認識させる、いわゆるサンドイッチ結合により測定するものです。
これは抗原が、複数の抗体に結合する場合(2価抗原)に用いられます。
まず抗体を固相(容器壁、ビーズなど)に固定化しておき、次に測定する抗原サンプルを加えて結合させ、放射性標識した別の抗体を加えると、標識が抗原の量に応じて固相に検出されます。
《競合法とサンドイッチ法の原理(イメージ)》
(※出典:上記の図は「役立つ薬の情報~専門薬学」のサイトより引用)
なお、単一の抗体産生細胞(ハイブリドーマ;hybridoma)に由来するクローンから得られた抗体(免疫グロブリン)分子であるモノクローナル抗体(monoclonal antibody/単クローン抗体とも呼ばれています)が開発され、標識イムノアッセイによる検出、定量はますます広い分野で利用されるようになりました。
特に、サンドイッチ法では、エピトープ(epitope:タンパク分子で抗原性をもつ部分)が異なる2種類のモノクローナル抗体を用いる方法は一般的です。
4.反応系による分類
(1)均一系による測定(Homogeneous assays)
測定が終始溶液状態で行なわれる測定系を言います。
均一エンザイムイムノアッセイ(均一EIA)では、例えばハプテンが用いられます。
ハプテン-酵素の複合体に抗ハプテン抗体を添加すると酵素活性は低下します。
単独のハプテンを添加すると、抗ハプテン抗体は単独のハプテンとも結合するので酵素活性の低下が抑えます。酵素活性とハプテン添加量には比例関係が見られます。
(2)不均一系による測定(Heterogeneous assays)
固相化された抗体などを用いて反応、洗浄が行なわれる測定系を言います。
5.その他のイムノアッセイ法
(1)イムノクロマトグラフィー(CG法)
先ず、イムノクロマトグラフィーの辞書的な定義を見てみましょう。
「抗原抗体反応を利用した、迅速検査の手法の一つ。」「抗体を含む標識粒子が敷き詰められたセルロース膜上に、血液などの検体を滴下することで行われる。仮に検体中に抗原が含まれていれば、その抗原と膜上の抗体が抗原抗体反応を起こして複合体を形成する。形成された複合体は、毛細管現象によって膜上を移動するが、その先には別種の抗体が線状に配置されており、複合体と結合して発色する仕組みになっている。」
(新語時事用語辞典「イムノクロマトグラフィー法」より抜粋)
イムノクロマトグラフィーの測定原理については、以下の資料の原理図を見ていただけると、視覚的に理解しやすいと思います。
- 日水製薬株式会社
サルモネラ(S.Enteritidis)検出用 簡易迅速キット「NHイムノクロマト サルモネラ」のパンフレット - 田中貴金属株式会社のサイト
診断薬のページ
なお、この技術は日本では「イムノクロマトグラフィーアッセイ」(Immuno-Chromatography Assay)または「ストリップテスト」(Strip test)と言われ、一般的な臨床検査にも使われており定着していますが、欧米では「ラテラルフローイムノアッセイ」(LFA;Lateral Flow assays/Lateral Flow Immunoassays)として知られているようです。
(2)化学発光イムノアッセイ
発光化合物を標識体として直接抗体に結合させた測定法である化学発光イムノアッセイ(CLIA)の他、
- 抗体に標識された酵素の基質として発光化合物(化学発光基質)を用い、発光化合物が酵素によって分解されることで発光する際の発光強度を測定する 化学発光酵素イムノアッセイ(CLEIA)
- 標識物質を電気化学的刺激により発光させ(電極反応に伴う電子の電荷移動エネルギーが発光エネルギーとなる)、その発光量を検出する 電気化学発光イムノアッセイ(ECLIA法)
などがあります。
標識物質として、CLIAではアクリジニウム、CLEIAではジオキセタン化合物(アドマンチル基、ジオキセタン骨格、フェニルリン酸基から構成されるAMPPD)やルミノール、ECLIA法ではルテニウム(Ru)錯体、などが用いられます。
なお、CLEIAのペルオキシダーゼ/ルミノール/過酸化水素による化学発光を増感する増感剤(Enhancer:パラヨードフェノールのようなフェノール類)が、感度を高めるために重要となってきます。
(3)表面プラズモン共鳴(SPR)イムノアッセイ
測定対象物質に対する抗体を金属薄膜に吸着させ、この抗体と被検液中に存在する抗原(測定対象物質)との間で抗原抗体反応を起こさせ、抗原抗体反応後における表面プラズモン共鳴現象に基づく共鳴角を検出し、共鳴角の変化から抗原の量を検出するイムノアッセイで、検体の検出に標識分子を必要としないという特徴があります。
なお、表面プラズモン共鳴(SPR)現象とは、金属薄層を有するプリズムの金属薄層に、プリズムを通して光を反射させると、その金属薄層の表面状態又は屈折率によって、ある角度で入射した場合には、エバネッセント波(高屈折率プリズムに光を全反射角で入射したときに、プリズムの外側にしみ出してプリズム表面上を伝播する表面波)の波数と表面プラズモンの波数とが一致して共鳴し、反射光強度が減衰する現象です。
(以上、特開平10-090271より)。
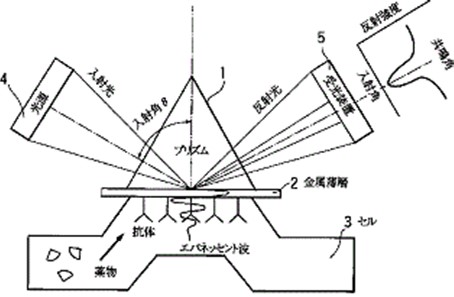
[特開平10-090271 図1より]
6.イムノアッセイの応用分野
イムノアッセイは、微量生体物質の分離や生体組織内の分布などを調べる基礎研究や食品中のアレルゲンの検出に用いられるほか、その最も大きな利用分野は、血中微量成分の臨床化学検査など体外診断用医薬品(臨床検査薬)です。
なお、富士経済府ループの調査結果よると、イムノアッセイの検査薬市場のおよそ7割は感染症、ホルモン、癌の3検査領域とのことです。
【参考】イムノアッセイの特許調査をするなら?
イムノアッセイに関する特許調査をするなら、先ず以下のような分類(FI)をチェックしてみましょう。
イムノアッセイに関するFIは、少なくとも180分類あり、多岐にわたっていますので、個々についてはご紹介しません。
特に重要と思われる個々のFIによる検索結果は以下の通りです。(※2018年5月の検索結果です)
| FI | ドット | 説明 | ヒット件数 |
| G01N33/531 | 4 | 免疫化学的試験物質の製造[4] | 4,446 |
| G01N33/533 | 6 | 蛍光標識を有するもの[4] | 873 |
| G01N33/534 | 6 | 放射性標識を有するもの[4] | 255 |
| G01N33/535 | 6 | 酵素標識を有するもの[4] | 612 |
| G01N33/536 | 4 | 液相中に形成された免疫複合体によるもの[4] | 1,901 |
| G01N33/539 | 6 | 沈澱試薬を含むもの[4] | 35 |
| G01N33/542 | 5 | 立体的阻害または信号の変更,例.蛍光偏光解消,によるもの[4]/均一系の免疫分析 | 681 |
| G01N33/543 | 4 | 免疫化学物質を固定化するための不溶性担体によるもの[4]/担体、固相を利用した免疫分析 | 13,988 |
| G01N33/557 | 4 | 動力学的測定,すなわち.抗原―抗体相互作用の進行速度,を用いるもの[4] | 92 |
| G01N33/558 | 4 | 抗原または抗体の拡散または移動を用いるもの[4] | 231 |
| G01N33/573 | 4 | 酵素またはイソ酵素のためのもの[4] | 1,487 |
| G01N33/574 | 4 | 癌のためのもの[4] | 5,313 |
| G01N33/576 | 4 | 肝炎のためのもの[4] | 866 |
| G01N33/577 | 4 | モノクローナル抗体を含むもの[4] | 5,022 |
(日本アイアール株式会社 特許調査部 A・A)
※参考文献(サイトURL)
- 富士フイルムワコーシバヤギ社のサイト:http://xn--ockr9eud.com/webinar/immunoassay/ia_03.html
- 「役立つ薬の情報~専門薬学」:https://kusuri-jouhou.com/immunity/kougen.html
- 富士経済グループ マーケット情報「免疫反応を用いて特定の物質を同定・測定するイムノアッセイの国内市場を調査」:https://www.fuji-keizai.co.jp/market/16023.html
☆イムノアッセイなどの測定/分析技術に関する特許調査は日本アイアールまでお問い合わせ下さい。