中国における輸入医療機器の登録について
目次
1. 中国における輸入医療機器登録について
2018年、「CFDA」(China Food and Drug Administration, 中国国家食品薬品監督管理局)は、「国家食品監督管理局」と「国家薬品監督管理局」となり、名称が変更されました。
「NMPA」(National Medical Products Administration, 中国国家薬品監督管理局)は、中国で販売する医療機器、医薬品、化粧品の審査認可を行う政府機関です。
中国へ医療機器を輸出する際は、医療機器NMPA登録証書を取得しなければなりません。
今回は中国における医療機器登録についてまとめました。
[※本記事は、2022年6月時点において、当研究所が把握できる範囲の情報をまとめたものです。中国の関係法令及びその解説など(中国語原語)を基に作成していますが、当研究所は掲載している情報の利用について一切の責任を負いかねます。必ず最新の情報を確認のうえ、必要に応じて専門機関・専門家に相談しながら実務を進めるようにしてください。]
2. 中国の医療機器登録に関する主な関係法令
(1)行政法規制
「医療機器監督管理条例」(国務院令第739号)2020年12月21日修訂
(2)行政通達・細則
| No. | 弁法・公告名 | 弁法・公告ナンバー | 施行開始時間 |
| 1 | 「医療機器登録管理弁法」 | 国家市場監督管理総局令第47号 | 2021年10月01日施行 |
| 2 | 「体外診断試薬登録管理弁法」 | 国家市場監督管理総局令第48号 | 2021年10月01日施行 |
| 3 | 「医療機器生産監督管理弁法」 | 国家市場監督管理総局令第53号 | 2022年05月01日施行 |
| 4 | 「国内第Ⅲ類と輸入医療機器の登録審査作業規範」 | 国薬監械注〔2021〕53号 | 2021年11月02日施行 |
| 5 | 「国内第Ⅱ類医療機器の登録審査作業規範」 | 国薬監械注〔2021〕54号 | 2021年11月02日施行 |
| 6 | 「国家薬品監督管理総局が輸入医療機器の登録申請者と届出者名称における中国語の使用に関する公告」 | 国家薬品監督管理総局公告2017年第131号 | 2017年10月31日施行 |
| 7 | 「医療機器分類⽬録」 | 国家薬品監督管理総局公告2017年第104号 | 2017年08月31日施行 |
| 8 | 「『医療機器分類⽬録』に関する一部の内容を調整する公告」 | 国家薬品監督管理総局公告2022年第30号 国家薬品監督管理総局公告2022年第25号 |
2022年03月28日施行 2022年03月22日施行 |
| 9 | 「第I類医療機器製品⽬録を公布することに関する公告」 | 国家薬品監督管理総局公告2021年第158号 | 2022年01月01日施行 |
| 10 | 「体外診断試薬の分類規則」 | 国家薬品監督管理総局公告2021年第129号 | 2021年10月27日施行 |
| 11 | 「医療機器の臨床試験品質管理規範」 | 国家薬品監督管理総局公告2022年第28号 | 2022年05月01日施行 |
| 12 | 「国家薬品監督管理総局が臨床評価から免除された医療機器のカタログの通告」 | 国家薬品監督管理総局通告2021年第71号 | 2021年10月01日施行 |
| 13 | 「国家薬品監督管理総局輸入医療機器の中国国内企業による生産に関する公告」 | 国家薬品監督管理総局公告2020年第104号 | 2020年09月18日施行 |
| 14 | 「医療機器の説明書とラベルの管理規制」 | 国家食品薬品監督管理総局令第6号 | 2014年10月01日施行 |
3. 医療機器の分類について
(1)リスクによる分類
NMPAは、医療機器をリスクにより3つのクラス(第Ⅰ類、第Ⅱ類、第Ⅲ類)に分類しています。
| 類別 | 説明 | 例 | 必要な手続き | 経営審査機関 |
| 第Ⅰ類 | 低リスク
通常の管理により安全性と有効性を保証できる医療機器 |
手術器具(ナイフ、はさみ、鉗子、フック)、スクレーピングボード、医療用X線フィルム、手術用ガウン、手術用キャップ、検査用手袋、ガーゼ包帯、ドレナージバッグなど。 | NMPA登録が必要。 | 製品および生産活動は所在する地区を含む市レベルでの食品医薬品局による記録管理の対象となる医療機器です。 |
| 第Ⅱ類 | 中リスク
安全性と有効性を保証するため、厳格な管理が必要とされる医療機器 |
医療用縫合針、血圧計、温度計、ECG装置、EEG装置、顕微鏡、鍼灸針、生化学的分析システム、補聴器、超音波消毒装置、非吸収性縫合糸、コンドームなど。 | NMPA審査、生産登録証発行が必要。 (新規医療機器の場合、臨床試験情報が必要) |
中央政府直轄の州、自治区および市政機関の医薬品規制当局の検査及び承認が必要となる医療機器です。 |
| 第Ⅲ類 | 高リスク
人体に危険を及ぼす可能性があり、安全性と有効性を保証するため、特別な措置を通じて厳格な管理が必要とされる医療機器 |
埋め込み型心臓ペースメーカー、角膜コンタクトレンズ、眼内レンズ、超節約腫瘍集束ナイフ、血液透析装置、埋め込み型機器、血管ステント、包括的麻酔装置、歯科インプラント材料、医療用吸収性縫合糸、血管内カテーテルなど。 | NMPA審査、生産登録証発行、4年毎の定期現場審査が必要。 (新規医療機器の場合、臨床試験情報が必要) |
NMPA(中国国家薬品監督管理局)の検査及び承認が必要となる医療機器です。 |
臨床試験は、NMPAにより発表された「医療機器の臨床試験品質管理規範」(2022年3月24日発行、5月1日から施行)(上記「行政通達・細則」の表の内容のNo.11」を参照)の要求事項により、中国政府の医薬品規制当局指定の医療機関で実施されます。
NMPAによって認証された「医療機器登録証」の有効期限は5年であり、有効期間が満了するまでの6カ月以内に再登録の申請が必要です。
(2)医療用途による分類
医療用途に応じた医療機器の分類規則やその調整もあります。
具体的な内容については、「行政通達・細則」の表の内容(No.7~10)をご参照ください。
(3)関税番号による分類
医療機器の関税番号は、主に9018、9021、9022、9402などに集中しています。税関申告書や輸出税の還付を輸出入する場合、対応する関税番号を商品ごとに検索します。
4.中国における医療機器の登録手続と必要書類
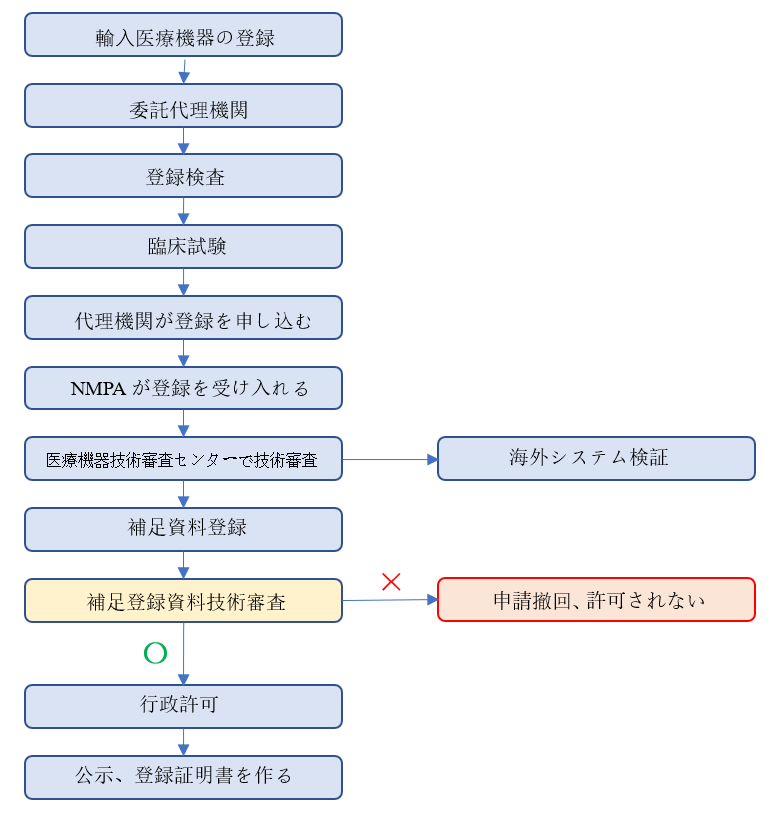
(1)登録の流れ
中国国外の⽣産企業は、中国国内の機関を代理⼈に指定する必要があります。
輸⼊医療機器の登録⼿続、アフターサービスなどにおいて、現地法⼈機関への委託、現地⼦会社への委託が必要です。
登録の流れは下記のとおりです。(参考まで)
(2)登録に必要な提出資料
第Ⅱ類および第Ⅲ類の医療機器登録資料は以下の通りです。(参考まで)
| No. | 資料内容 |
| 1 | 申込書 |
| 2 | 関連する証明書(電子証明書を含む) |
| 3 | 医療機器の安全性と有効性の基本要件のリスト |
| 4 | 要約情報資料 |
| 5 | 製品の研究開発資料 |
| 6 | 製品の生産に関する品質マネジメントシステム文書 |
| 7 | 臨床評価資料 ※臨床試験免除リストに掲載の医療機器及び同様の製品が既にNMPAによって承認されている医療機器を除き、臨床試験実施機関での臨床試験の実施が必要。 |
| 8 | 製品のリスク分析に関する資料 |
| 9 | 製品技術要件書 |
| 10 | 製品登録検査報告書 |
| 11 | 製品の説明書及びラベルの印刷見本 |
| 12 | 適合性声明 |
| 13 | その他の文書 |
(3)審査の流れ
NMPAの説明によれば、審査の流れと所要時間は次のとおりです。
審査の法定完了時間と承諾完了時間制限はどちらも188営業日です。
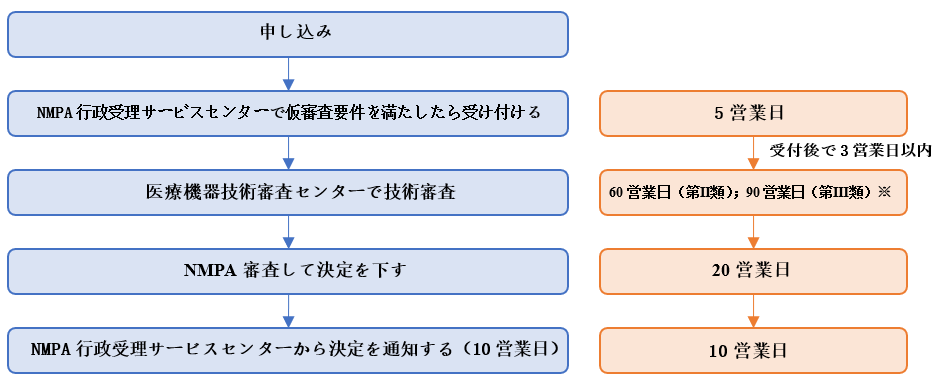
※① 外部の専門家による審査が必要であり、薬剤とデバイスの組み合わせ製品を薬剤審査機関と共同で審査する必要がある場合、必要な時間は含まれず、技術審査センターは申請者に必要な時間を書面で通知するものとします。
② 品質マネジメントシステムの検証時間と申請者が資料を補足する時間は審査期限に含まれず、技術審査センターは補足資料の受領日から60営業日以内に技術審査を完了するものとします。
5.体外診断試薬について
体外診断用薬は、医療機器として管理されている体外診断用試薬を指します。疾患の予測、予防、診断、治療モニタリング、予後観察、健康状態評価の過程で人間のサンプルを体外で検出するための試薬、キット、キャリブレーター、品質管理製品などの製品を含みます。単独で使用することも、機器、アプライアンス、デバイス、またはシステムと組み合わせて使用することも可能です。
(1)体外診断試薬の分類
NMPAは、体外診断試薬をリスクによって3つのクラス(第Ⅰ類、第Ⅱ類、第Ⅲ類)に分類しています。
| 類別 | 説明 | 分類による | 例 |
| 第Ⅰ類 | 低リスク | 公衆の健康上のリスクはなく、日常的な管理により、安全で効果的な体外診断試薬を確保できる。 |
|
| 第Ⅱ類 | 中リスク | 不正確なテスト結果が、生命を危険にさらしたり、重大な障害を引き起こしたりすることはないが、安全で効果的な体外診断試薬を確保するために厳格な管理が必要である。 |
|
| 第Ⅲ類 | 高リスク | 臨床診断のための重要な情報を提供するために、誤った結果が個人および/または公衆の健康の安全に深刻な脅威をもたらす。その安全で効果的なインビトロ診断試薬を確保するために、厳密に管理するための特別な措置を講じる必要がある。 |
|
(2)中国の体外診断試薬の登録許可状況
NMPAは「2021年度医療機器登録報告書」において、医療機器登録件数を発表しました。
医療機器の初期登録、更新登録、登録変更の合計で12,255件の申請を受け付け、2020年と比較して15.8%増加しました。また、11314件の登録申請承認をし、前年比14.9%増となっています。
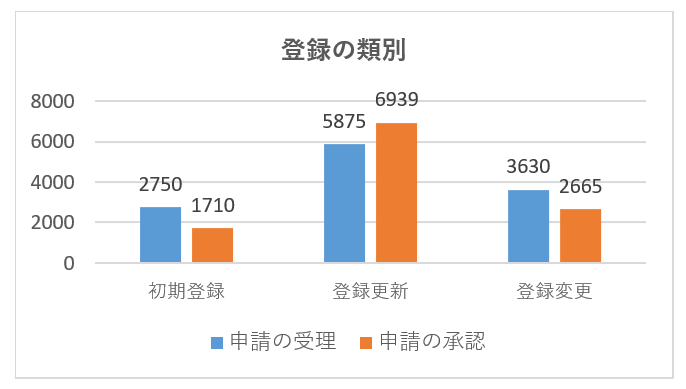
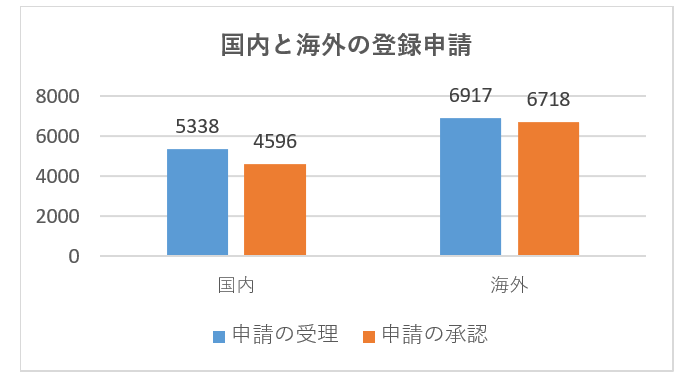
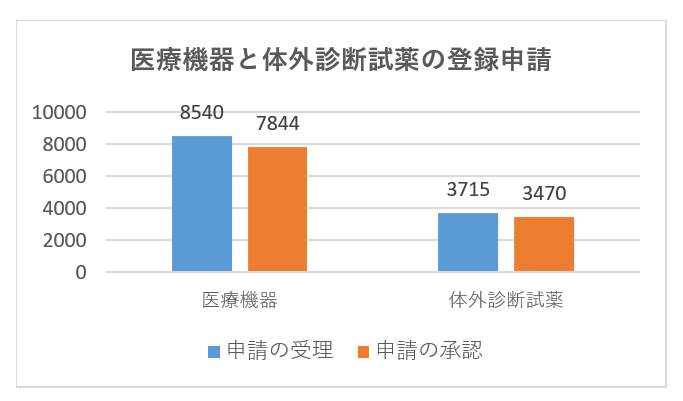
具体的な登録申請の受理と承認のデータを次の図に示します。
| 2021年度 | 国内第Ⅲ類 | 海外第Ⅱ類 | 海外第Ⅲ類 | 合計 | |||
| 医療機器 | 体外診断試薬 | 医療機器 | 体外診断試薬 | 医療機器 | 体外診断試薬 | ||
| 申請 | 3733 | 1605 | 2048 | 1641 | 2759 | 469 | 12255 |
| 初期登録 | 1546 | 334 | 337 | 98 | 406 | 29 | 2750 |
| 登録更新 | 1269 | 887 | 1177 | 945 | 1334 | 263 | 5875 |
| 登録変更 | 918 | 384 | 534 | 598 | 1019 | 177 | 3630 |
| 承認 | 3079 | 1517 | 2132 | 1517 | 2633 | 436 | 11314 |
| 初期登録 | 921 | 227 | 54 | 271 | 27 | 1710 | |
| 登録更新 | 1601 | 1018 | 1449 | 971 | 1607 | 293 | 6939 |
| 登録変更 | 557 | 289 | 456 | 492 | 755 | 116 | 2665 |
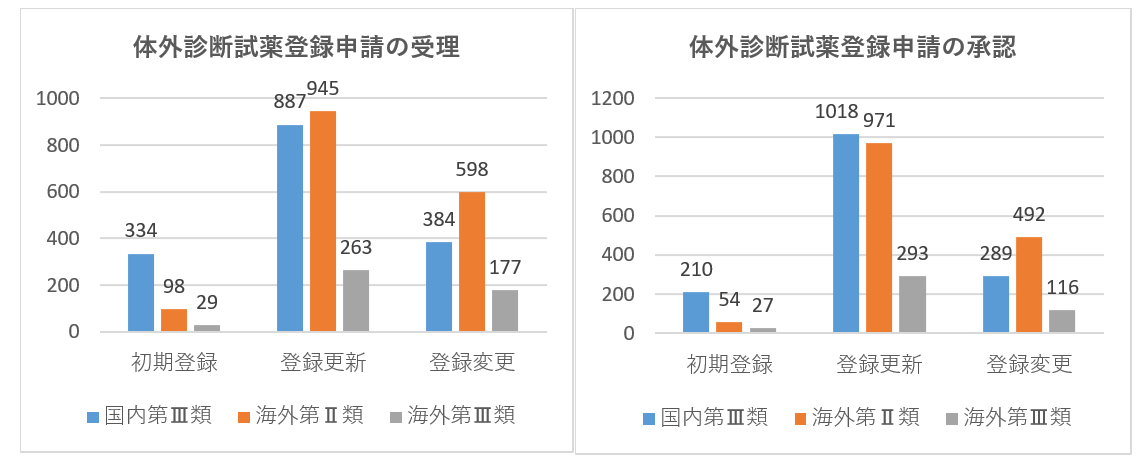
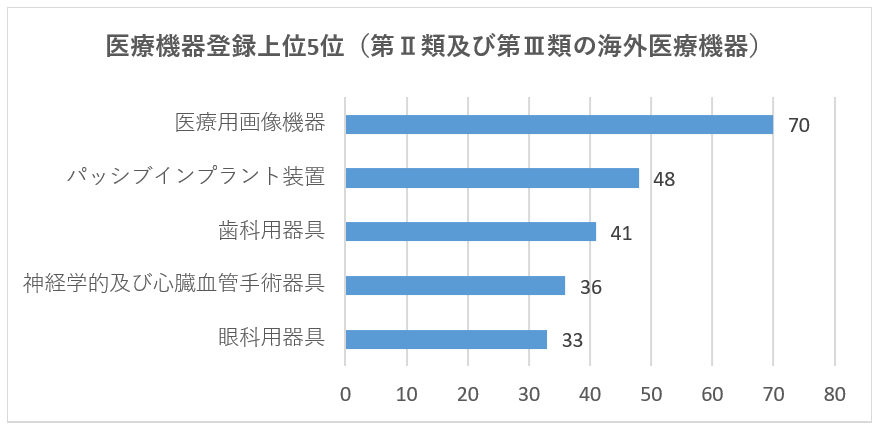
登録された輸入医療機器は、体外診断試薬を除き、「医療機器分類⽬録」に合計20種類が含まれています。登録数の上位5つの輸入医療機器は、主に医療用画像機器、パッシブインプラント装置、歯科用器具、神経学的及び心臓血管手術器具、および眼科用器具であり、2020年と同じです。その中で、医療用画像機器は2020年の63から70に増加し、約11.1%増加しました。パッシブインプラント装置は41から48に増加し、約17.1%増加し、残りの種類の登録数はわずかに減少しました。
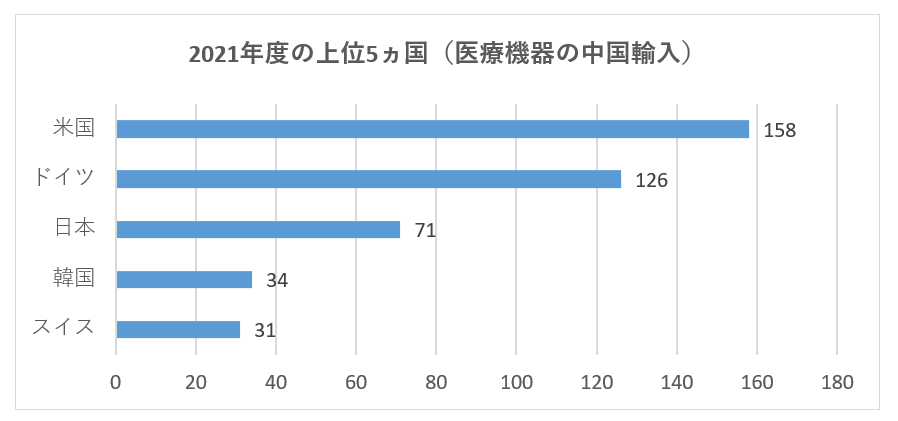
2021年には、合計27か国(地域)が中国への申請を承認されており、その中で、米国、ドイツ、日本、韓国、スイスからの医療機器の初回登録数が、中国の医療機器輸入の上位5ヵ国であり、登録製品数は全体の約72.5%を占めています。2021年の海外初回登録件数は基本的に2020年と同じです。
(3)輸入された体外診断試薬の登録申請
体外診断試薬の登録資料は以下の通りです(参考まで)。
| No. | 資料内容 |
| 1 | 申込書 |
| 2 | 関連する証明書(電子証明書を含む) |
| 3 | 要約情報資料 |
| 4 | 主な原材料の研究開発資料 |
| 5 | 主な製造工程と反応システムの研究資料 |
| 6 | 分析性能の評価資料 |
| 7 | 陽性判定値または参考区間決定資料 |
| 8 | 安定性研究資料 |
| 9 | 生産および自己検査の記録 |
| 10 | 臨床評価資料 ※臨床試験免除リストに掲載の医療機器及び同様の製品が既にNMPAによって承認されている医療機器を除き、臨床試験実施機関での臨床試験の実施が必要。 |
| 11 | 製品のリスク分析に関する資料 |
| 12 | 製品技術要件書 |
| 13 | 製品登録検査報告書 |
| 14 | 製品の説明書及びラベルの印刷見本 |
| 15 | 適合性声明 |
| 16 | その他の文書 |
上記の登録資料から、医療機器や体外診断試薬の登録資料には多くの共通の内容があることがわかります。
これは、医療機器の一種としての体外診断試薬が、一般的な監督の点で従来の医療機器と一致していることを示しています。
医療機器と体外診断試薬に関するNMPAの審査の標準は基本的に同じであり、製品の安全性と有効性に焦点を当てています。ただし、製品の種類ごとに固有の要件が異なるため、自社の各製品ごとに審査に対応した技術資料を作成しておくと便利です。
6. 中国での医療機器事業推進には最新の実務情報収集が不可欠
中国の医療機器関連市場は大きく、現在も発展を続けています。現地の政策をより詳細に理解し、適切な市場進出戦略を制定する必要があります。
中国における医療機器や体外診断用試薬の登録について詳しく学びたい方は、ぜひ当サイトに掲載している中国薬事関連セミナーもチェックしてみてください。
(日本アイアール株式会社 特許調査部 J・C)
《引用・参考文献》※いずれも中国語原文の情報となります。
- [1] 「医療機器監督管理条例」(国務院令第739号)
http://www.gov.cn/zhengce/content/2021-03/18/content_5593739.htm - [2] 「医療機器登録管理弁法」(国家市場監督管理総局令第47号)
http://www.gov.cn/gongbao/content/2021/content_5654783.htm - [3] 「体外診断試薬登録管理弁法」(国家市場監督管理総局令第48号)
http://www.gov.cn/gongbao/content/2021/content_5654784.htm - [4] 「医療機器生産監督管理弁法」(国家市場監督管理総局令第53号)
https://www.nmpa.gov.cn/xxgk/fgwj/nbmgzh/20220322172616119.html - [5] 「国内第Ⅲ類と輸入医療機器の登録審査作業規範」(国薬監械注〔2021〕53号)
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20211104141907123.html - [6] 「国内第Ⅱ類医療機器の登録審査作業規範」(国薬監械注〔2021〕54号)
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20211104142753166.html - [7] 「国家薬品監督管理総局が輸入医療機器の登録申請者と届出者名称における中国語の使用に関する公告」(国家薬品監督管理総局公告2017年第131号)
https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20171102103501609.html - [8] 「医療機器分類⽬録」(国家薬品監督管理総局公告2017年第104号)
https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20170904150301406.html - [9] 「『医療機器分類⽬録』に関する一部の内容を調整する公告」(国家薬品監督管理総局公告2022年第30号)
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220330144627167.html - [10] 「『医療機器分類⽬録』に関する一部の内容を調整する公告」(国家薬品監督管理総局公告2022年第25号)
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220324153614110.html - [11] 「第I類医療機器製品⽬録を公布することに関する公告」(国家薬品監督管理総局公告2021年第158号)
https://www.nmpa.gov.cn/ylqx/ylqxggtg/20211231171223126.html - [12] 「体外診断試薬の分類規則」(国家薬品監督管理総局公告2021年第129号)
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20211029152805184.html?type=pc&m= - [13] 「医療機器の臨床試験品質管理規範」(国家薬品監督管理総局公告2022年第28号)
https://www.nmpa.gov.cn/ylqx/ylqxggtg/20220331144903101.html - [14] 「国家薬品監督管理総局が臨床評価から免除された医療機器のカタログの通告」(国家薬品監督管理総局通告2021年第71号)
https://www.nmpa.gov.cn/ylqx/ylqxggtg/20210918150708171.html?type=pc&m= - [15] 「国家薬品監督管理総局輸入医療機器の中国国内企業による生産に関する公告」(国家薬品監督管理総局公告2020年第104号)
https://www.nmpa.gov.cn/ylqx/ylqxggtg/ylqxqtgg/20200925152407171.html - [16] 「医療機器の説明書とラベルの管理規制」(国家食品薬品監督管理総局令第6号)
https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20140730180001248.html - [17] 医療機器臨床試験申請機関のリスト
https://www.nmpa.gov.cn/zhuanti/cxylqx/ylqxxgmlhz/20210531163352160.html - [18] 医薬品・医療機器臨床試験申請機関の管理情報システム
https://beian.cfdi.org.cn/CTMDS/apps/pub/public.jsp - [19] 輸入医療機器登録申請審査の流れ(国家薬品監督管理総局オンライン事務所)
https://zwfw.nmpa.gov.cn/web/taskview/11100000MB0341032Y100017204400101 - [20] 国家薬品監督管理局「2021年度医療機器登録報告書」
https://www.nmpa.gov.cn/yaowen/ypjgyw/20220127090648139.html
- バイオ/医薬/医療分野の中国語技術翻訳・薬事翻訳はこちら(別サイト「中国語翻訳PRO」へ)